
|
|||
|---|---|---|---|
|
|
Radicales libres, estrés oxidativo y ejercicio |
|
|
|
Laboratorio de Neurobiología del Desarrollo Instituto de Investigaciones Bioquímicas de Bahía Blanca |
Lic. María Fernanda Insua mfinsua@criba.edu.ar (Argentina) |
|
|
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 9 - N° 66 - Noviembre de 2003 |
|
|
1 / 1
El ejercicio de alta intensidad induce estrés oxidativo, sin embargo no hay evidencia acerca de que afecte la performance deportiva en el corto plazo, aunque podría tener consecuencias en la salud a largo plazo.
Los mecanismos que subyacen al estrés oxidativo inducido por el ejercicio aún no son bien comprendidos, pero las mitocondrias son a menudo consideradas como la principal fuente de formación de radicales libres, aunque estudios in vitro sugieren que jugarían un rol menos importante de lo que se creía en un primer momento. Por otra parte existe una creciente aceptación de la importancia de las proteínas hemo, como inductoras de estrés oxidativo. De hecho la liberación de metamioglobina desde el músculo dañado se sabe que causa falla renal en la rabdomiólisis por ejercicio. Además los niveles de metamioglobina se incrementan durante el ejercicio de alta intensidad, al tiempo que disminuyen las moléculas antioxidantes naturales en el cuerpo, como el glutatión reducido.
Se ha sugerido que el daño mediado por radicales libres causado por la interacción de metamioglobina y metahemoglobina con los peróxidos podría ser una importante fuente de estrés oxidativo durante el ejercicio.
Radicales libres y estrés oxidativoLos radicales libres son especies químicas que poseen uno o más electrones desapareados, capaces de existir en forma independiente, que se producen en todas las células. La mayoría de los radicales que se producen in vivo son originados tanto a partir de las especie reactivas de oxígeno (ROS) como de nitrógeno (RNS).
Los ROS incluyen radicales basados en el oxígeno, por ej. el superóxido (O2·-), hidroxilo u oxhidrilo (OH·), alkoxilo (RO·), peroxilo (ROO·), e hidroperoxilo (RHOO·). Otras ROS, como por ejemplo el peróxido de hidrógeno (H2O2) y los peróxidos lipídicos, tienen la capacidad de ser convertidos en radicales libres por metales de transición tanto libres en la célula como unidos a proteínas.
Las RNS incluyen los radicales libres óxido nítrico (NO·), dióxido de nitrógeno (NO2·) y el potente oxidante peroxinitrito (ONOO-).
Los radicales libres tienen el potencial de reaccionar con una variedad de especies químicas, ya que participan en un amplio rango de funciones biológicas en la señalización celular (ej. NO·) y en la enzimología (ej. el rol de los radicales libres unidos a proteínas en el mecanismo de una variedad de reductasas, peroxidasas, catalasas y oxidasas). Las ROS también se producen inadvertidamente en el cuerpo, mediante una variedad de mecanismos. La mayoría de los radicales libres producidos in vivo son oxidantes, capaces de oxidar una gama de moléculas biológicas, incluyendo carbohidratos, aminoácidos, ácidos grasos y nucleótidos. Como es imposible prevenir la producción in vivo de todos los radicales libres, no es sorprendente que se hayan desarrollado en el cuerpo una cantidad de defensas antioxidantes, de hecho están presentes antioxidantes enzimáticos y no enzimáticos.
Las enzimas antioxidantes incluyen la superóxido dismutasa (SOD), la glutatión peroxidasa (GPX), y la catalasa, mientras que los principales antioxidantes no enzimáticos incluyen el glutatión (GSH), la vitamina C y la E, el ácido a-lipoico, los carotenoides, la bilirrubina y la ubiquinona. (Ver tabla 1)
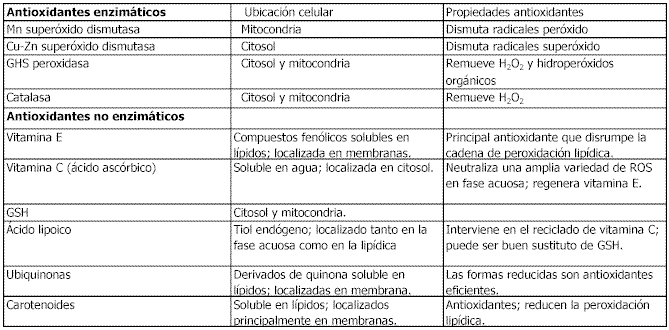
Tabla 1. Antioxidantes enzimáticos y no enzimáticos (modificado de Powers y Lennon, 1999)Las defensas antioxidantes existentes en el cuerpo son suficientes y adecuadas para prevenir un daño sustancial a los tejidos, sin embargo, no hay un exceso de estas sustancias, y una sobreproducción de radicales libres, o una caída en el nivel de las defensas antioxidantes conducirá a un desbalance, que podría provocar efectos deletéreos, una situación conocida como estrés oxidativo.
Existen claras indicaciones que muestran que el ejercicio tiene el potencial de incrementar la producción de radicales libres y conducir a estrés oxidativo.
Posibles mecanismos de producción de radicales libres durante el ejercicio Durante el ejercicio hay un incremento en la liberación de catecolaminas, cuya auto-oxidación puede producir radicales libres. El daño muscular luego del ejercicio puede causar inflamación y liberación de superóxido desde la NADPH oxidasa de los neutrófilos. Sin embargo, usualmente se piensa que una de las fuentes más importantes de ROS durante el ejercicio, es la producción mitocondrial de superóxido, mediante reacciones secundarias de los radicales flavina o ubisemiquinona (UQH-) con el oxígeno: UQH· - + O2 = UQ + O2· - + H+ [ecuación 1].
La actividad física incrementa considerablemente la demanda de energía, y para proveer de este oxígeno, el cuerpo podría aumentar su captación tanto como 15 veces, y el flujo de oxígeno a través de los músculos activos podría incrementarse tanto como aproximadamente 100 veces respecto a los valores de reposo. Consecuentemente, se argumenta que un aumento sustancial en la producción de superóxido mitocondrial, es inevitable, sin embargo este fundamento adolece de algunas fallas: primeramente, la velocidad de producción de superóxido por la ecuación 1 es linealmente dependiente de la tensión de oxígeno y esto lleva a una disminución de la producción de superóxido cuando la pO2 desciende (como podría esperarse en el músculo activo). Por otra parte el radical ubisemiquinona no aumenta automáticamente a medida que el flujo a través de la cadena de transporte de electrones se incrementa. De hecho, el descenso del potencial de la membrana mitocondrial (como ocurre cuando las mitocondrias del músculo aumentan su velocidad de producción de ATP) disminuye la producción mitocondrial de radicales libres. Esto sucede a pesar de un dramático incremento de la velocidad de consumo de oxígeno.
Debe notarse que la mayoría de los estudios que muestran altas velocidades de producción de superóxido mitocondrial in vitro están hechos en mitocondrias inhibidas a pO2 suprafisiológica, es decir, en la condición opuesta a la que se encuentra en el músculo en ejercicio. Esto no significa que la mitocondria no pueda ser una fuente de radicales libres durante la actividad física, sin embargo se requieren investigaciones in vivo para responder directamente esta pregunta, en lugar de asumir que un mayor consumo mitocondrial de oxígeno significa mayor producción mitocondrial de radicales libres.
Un mecanismo alternativo por el cual el ejercicio podría promover la producción de radicales libres involucra la isquemia-reperfusión. El ejercicio intenso está asociado con una hipoxia tisular transitoria en varios órganos (ej. riñones, región esplácnica), ya que la sangre es desviada para cubrir la demanda aumentada de sangre de los músculos esqueléticos activos y la piel. Además de esto, durante el ejercicio realizado a intensidades muy altas, las fibras musculares pueden sufrir hipoxias relativas, ya que el aporte de oxígeno no puede satisfacer los requerimientos de energía. Al término del ejercicio, ocurre la re-oxigenación de estos tejidos, la cual puede estar asociada con la producción de ROS. Una manera en la cual la reperfusión podría conducir a un incremento en la producción de ROS es a través de la conversión de la xantina deshidrogenasa (XDH) en xantina oxidasa (XOD). Tanto la XDH como la XOD catalizan la degradación de la hipoxantina (HX) en xantina (X), y subsecuentemente en urato. Sin embargo, sólo XOD produce O2 · - en el último paso de esta reacción.
La producción de ROS vía este mecanismo conduce a estrés oxidativo varias horas después del ejercicio, y no está restringido al músculo esquelético. Interesantemente, en un estudio reciente, radicales libres marcadores de estrés oxidativo, se redujeron significativamente en animales y humanos luego de la adición de alopurinal, un inhibidor de la XOD. La xantina oxidasa podría ser más importante que la mitocondria como fuente de radicales libres producidos por el ejercicio.
¿El ejercicio induce estrés oxidativo?En 1978 se demostró por primera vez que el ejercicio físico podía conducir a un incremento en la peroxidación lipídica. Dillard y col. observaron un aumento de 1,8 veces en el nivel de pentosas exhaladas, un posible subproducto del daño oxidativo lipídico, luego de 60 minutos de bicicleta a 25-75% del VO2máx. Desde entonces se han acumulado crecientes evidencias que sostienen la hipótesis de que la actividad física tiene el potencial de aumentar la producción de radicales libres y conducir al estrés oxidativo. Medir la producción de radicales libres directamente es difícil, principalmente por la corta vida de estas especies.
La mayoría de las investigaciones que estudian los efectos del ejercicio sobre el estrés oxidativo, sin embargo, se han enfocado en los marcadores de daño tisular inducido por radicales libres, encontrando señales de daño incrementado en lípidos, proteínas y ADN.
También han sido estudiados los cambios inducidos por el ejercicio en los niveles de antioxidantes, pero su significación para el estrés oxidativo es difícil de determinar. Mientras que el estrés oxidativo podría causar una primera disminución en los antioxidantes, la movilización de fuentes secundarias de otras partes del cuerpo, podría resultar en un aparente aumento. Además la relación GSH/GSSG en la sangre ha sido consistentemente demostrado que decrece con el ejercicio, mientras que los niveles plasmáticos de vitamina C y E tienden a incrementarse. Por otra parte, aunque cambios en el estado de oxidación o en la concentración de antioxidantes puedan llegar a deteriorar las defensas antioxidantes, no indican necesariamente daño tisular. No está claro qué causa estos cambios, o en que medida influencian el estrés oxidativo.
Algunos investigadores han fallado en la observación de cualquier signo de estrés oxidativo inducido por el ejercicio, y esto puede ser debido a varias razones. En primer lugar, el uso de diferentes sujetos de testeo podría influenciar los hallazgos de diferentes investigaciones; factores tales como el estado de entrenamiento, la edad y el género también podrían jugar un rol importante. Además, se ha utilizado una amplia variedad de protocolos de ejercicio, pero solamente el ejercicio de alta intensidad o de larga duración parece conducir a un incremento suficientemente grande en la producción de radicales libres, como para sobrepasar las defensas antioxidantes.
Un estudio ha demostrado que correr en cinta al máximo de la capacidad, aumenta los niveles de malondialdehído (MDA), mientras que correr a una intensidad más moderada (70% VO2 máx) no produjo este efecto, y el correr a baja intensidad (40% VO2 máx), aún disminuyó este marcador de estrés oxidativo. Algunos productos de las reacciones oxidativas no estarían elevados directamente luego del ejercicio, y alcanzarían sus niveles máximos sólo horas o aún días después de finalizado el ejercicio, por lo tanto, la ausencia de signos de estrés oxidativo inmediatamente luego del ejercicio no necesariamente implica que no haya ocurrido daño oxidativo.
Una investigación estudió los niveles de antioxidantes plasmáticos y las injurias celulares luego de actividad física severa. Este tipo de actividad conduce al incremento de la tasa metabólica, al aumento de la producción de ROS y un compromiso de los sistemas de defensa antioxidantes.
Durante 6 meses, un grupo de hombres entrenaron 5 días a la semana, sometidos a dos marchas extremas de 50 km y 80km a nivel del mar, separadas por 2 semanas de entrenamiento regular. Cada participante llevó 35 kg de peso extra, y las muestras de sangre se tomaron inmediatamente antes y después de cada marcha.
Los niveles plasmáticos reducidos de ácido ascórbico, ascorbato total y dehidroascorbato no sufrieron cambios significativos durante cada marcha. Sin embargo hubo un aumento de los niveles plasmáticos de ácido úrico (25% en la marcha de 50km y 37% en la de 80 km), debido presumiblemente a incrementos en la tasa metabólica y en el consecuente aumento del metabolismo de los nucleótidos pirimidínicos.
Ambas marchas condujeron a aproximadamente un incremento de 10 veces en la creatina fosfokinasa plasmática, mientras que los niveles de aspartato transaminasa, un marcador característico de daño hepático, aumentó aproximadamente 4 veces. Los niveles de bilirrubina, creatina, urea y glucosa también se incrementaron.
Ha sido bien demostrado que el principal factor responsable del año oxidativo durante el ejercicio es el incremento en el consumo de oxígeno. Sin embargo, otros factores teóricos (acidosis, auto-oxidación de catecolaminas, síndrome de isquemia-reperfusión, etc.) que se saben inducen, in vitro, daño oxidativo, podrían estar operando durante el ejercicio anaeróbico supramáximo de corto tiempo (test Wingate, de 30s). Un estudio ha hipotetizado que este tipo de ejercicio podría inducir un daño oxidativo.
Se midieron los marcadores de peroxidación lipídica (niveles de producción sérica de radicales lipídicos y de malondialhehído plasmático), así como también las actividades de enzimas antioxidantes eritrocitarias (glutatión peroxidasa (GPx), superóxido dismutasa (SOD)) y los niveles de glutatión eritrocitario (GSH), en reposo, luego del test Wingate y durante 40min de recuperación.
La recuperación del ejercicio estuvo asociada con un aumento significativo (2.7 veces) en la producción de radicales lipídicos, así como también con cambios en las actividades de GSH (-13.6%) y SOD (-11.7%). En conclusión, este estudio sugiere que el ejercicio anaeróbico supramáximo de corto tiempo induce estrés oxidativo.
Al respecto, otro estudio, testeó si el test Wingate resultaba en estrés oxidativo suficiente (evaluado por los niveles de radicales lipídicos) para alterar el status plasmático de antioxidantes no enzimáticos. Se demostró que 1) el test Wingate incrementa las concentraciones de ácido úrico y ascórbico, y disminuyen los niveles de alfa tocoferol y beta-caroteno; 2) los niveles de radicales lipídicos en reposo y en el sprint se correlacionan negativamente con las concentraciones plasmáticas en reposo de ácido úrico y alfa tocoferol.
En conclusión, este estudio demuestra que el ejercicio anaeróbico de sprint de 30s está asociado con cambios agudos en los niveles de antioxidantes no enzimáticos. Además, los sujetos con mayor potencia máxima en piernas son aquellos que exhiben los niveles de antioxidantes plasmáticos más bajos en reposo (ácido úrico y alfa tocoferol). Según los autores la ingesta de antioxidantes para mantener su concentración plasmática en reposo en el rango normal, podría proteger a los atletas contra el estrés oxidativo inducido por el ejercicio.
¿El estrés oxidativo inducido por el ejercicio afecta la performance deportiva?Es ampliamente asumido que el estrés oxidativo es perjudicial para la performance deportiva, pero de hecho existe poca evidencia experimental para sustentar esta afirmación.
En estudios animales se ha demostrado que agregando XOD exógena para generar radicales libres, se puede dañar la función muscular, y que la suplementación con antioxidantes puede atenuar la fatiga. Sin embargo, a pesar de que este último recurso puede disminuir el estrés oxidativo inducido por el ejercicio en humanos, no existe evidencia experimental convincente de que esto esté acompañado por aumento en el rendimiento durante el ejercicio, en sujetos sanos.
Parece razonable asumir que si el estrés oxidativo tuvo un gran efecto perjudicial en la performance, la suplementación con antioxidantes debería tener el potencial de producir una ayuda ergogénica. La ausencia de ese tipo de efecto sugiere que el estrés oxidativo inducido por el ejercicio tiene efectos menores sobre la performance en el corto plazo; los efectos a largo plazo en la salud no pueden ser rápidamente descartados, dada la enorme variedad de enfermedades que se encuentran asociadas con una producción exacerbada de radicales libres.
Por otro lado el incremento en el estrés oxidativo durante el ejercicio podría señalar un aumento en las defensas antioxidantes que protegen contra una gran variedad de estímulos oxidativos estresantes.
Hemoglobina y mioglobina: fuentes de estrés oxidativo inducido por el ejercicio?
Estudios realizados por el grupo de investigación del Dr. Cooper, se han centrado en el rol de las proteínas hemo como inductores de estrés oxidativo. Particularmente, tanto la mioglobina como la hemoglobina tienen la capacidad de generar ROS y aumentar la reactividad de las ROS generadas por otras vías:
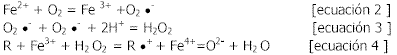
La auto-oxidación de la oxihemoglobina y oximioglobina (ecuación 2) conduce a la formación de superóxido (ecuación 2) y subsecuentemente a la formación de peróxido (ecuación 3).
Los peróxidos pueden reaccionar con las proteínas hemo férricas para formar dos oxidantes fuertes: hierro ferril (Fe4+=O2-) y R ·+ . La ecuación 4 proporciona las bases para la actividad catalítica de una gama de enzimas involucradas en la remoción de ROS (por ej. catalasa), generación de oxidantes bactericidas (por ej. la mieloperoxidasa de los neutrófilos) o la biosíntesis (ej. prostaglandina H sintasa). Sin embargo, estas enzimas están diseñadas para controlar la reactividad de los productos de la ecuación 4, de manera de ser usadas solamente sobre los sustratos apropiados.
La hemoglobina y la mioglobina no están diseñadas para cumplir este rol y el hierro ferril y los radicales libres que ellas producen pueden reaccionar con una variedad de materiales biológicos, la mayoría, notablemente, iniciando la peroxidación lipídica.
La velocidad de auto-oxidación de la hemoglobina tiene un dependencia inusual de la pO2 en forma de campana, por lo tanto, en contraste con la situación mitocondrial, la producción de ROS por parte de la hemoglobina puede aumentar con una disminución en la pO2 de la sangre capilar y venosa, asociada con el ejercicio. La combinación de las ecuaciones 2-4 conduce a la producción de radicales libres unidos a la hemoglobina en la sangre de sujetos sanos, pero si esta vía es una fuente significativa de ROS durante el ejercicio de alta intensidad permanece aún por dilucidarse. Sin embargo, recientemente se ha detectado un incremento perdurable en hemoglobina férrica luego de correr cuesta abajo, que está asociado con una disminución de GSH en la sangre.
La producción de superóxido a partir de hemoglobina podría aumentar la concentración de proteína hemo férrica (ecuación 2) y depletar las defensas antioxidantes de los eritrocitos (2GSH + H2O2 = GSSG +2H2O).
El ejemplo más claro de daño por radicales libres inducidos por la proteína hemo, proviene de situaciones donde la proteína hemo es removida del ambiente en que se hallan defensas antioxidantes contra ella . En ausencia de enzimas globina reductasa, la concentración de las especies reactivas férricas aumenta significativamente. Este es el caso cuando se utilizan los sustitutos sanguíneos basados en hemoglobina para mejorar la disponibilidad de oxígeno a los pacientes, y es particularmente cierto en la enfermedad llamada rabdomiólisis, que puede ser causada por un número de factores incluyendo el ejercicio. En este último caso, el daño muscular causa liberación de mioglobina en el plasma, entonces la mioglobina se acumula en los riñones, y se ha demostrado en un modelo animal, que la mioglobina se encuentra en el estado férrico allí, y se inicia la peroxidación lipídica, en particular la conversión de ácido araquidónico a F2-isoprostanos vasoconstrictores. Esta situación lleva a una disminución en la pO2, conduciendo a glucólisis y a una caída en el pH del tejido.
La reactividad de la mioglobina férrica con los peróxidos es fuertemente aumentada a valores de pH más ácidos que 7. Por lo tanto una vez que los niveles de F2-isoprostanos aumentan por encima de un nivel crítico, se pone en movimiento un círculo vicioso, donde un vasoconstrictor disminuye el pH, el cual, a su vez, aumenta la concentración del vasoconstrictor. Un tratamiento clínico para la rabdomiólisis es la alcalinización del plasma: aumentando el pH, se puede disminuir la reactividad de la mioglobina, disminuir los niveles de F2-isoprostano, induciendo la vasodilatación y por lo tanto incrementando el envío de oxígeno en el tejido. Esto a su vez disminuiría la glucólisis y la producción de ácido láctico, además de aumentar el pH tisular.
Vitaminas C y E: su efectividad como antioxidantesSe ha demostrado que la vitamina C y especialmente la vitamina E disminuyen el incremento de la velocidad de peroxidación lipídica inducida por el ejercicio, sin embargo no han sido reportados efectos ergógenicos para ninguna de las dos vitaminas.
La vitamina E aumenta significativamente los neutrófilos circulantes en sangre, en sujetos de más edad, pero no en los más jóvenes que realizan ejercicios excéntricos, que causan daño en el músculo esquelético. Además del efecto descrito, la vitamina E causa un incremento mayor en la actividad de la creatina kinasa circulante, quizás indicando un aumento en la reparación del músculo. Un consumo aumentado de vitamina E ha sido asociado con una mejora en la tolerancia a la glucosa y en la acción de la insulina, como así también con mejores condiciones en los niveles de lipoproteínas
ConclusiónEl ejercicio de alta intensidad induce estrés oxidativo, sin embargo no hay evidencia suficiente acerca de que afecte la performance deportiva a corto plazo, aunque podría tener consecuencias a largo plazo, no necesariamente negativas sobre la salud.
Los mecanismos de estrés oxidativo inducido por el ejercicio no se comprenden todavía con claridad, a pesar de que estudios recientes sugieren que las proteínas hemo podrían jugar un rol importante como iniciadoras y transductoras del daño por radicales libres.
Aunque la suplementación a corto o largo plazo con vitaminas C y E no posee efecto ergogénico en el ejercicio submáximo, la capacidad aeróbica y la fuerza muscular, la protección contra la generación de radicales de oxígeno y la peroxidación lipídica observada en personas no entrenadas realizando ejercicio, y la mejora en la respuesta al ejercicio excéntrico observada en sujetos no entrenados de más edad, indican que la vitamina E podría tener algún beneficio en la respuesta adaptativa al ejercicio.
Resulta evidente que nuevas investigaciones deben realizarse para comprender: -los efectos de ambas vitaminas por separado y en conjunto sobre el entrenamiento de la fuerza, -el efecto combinado del ejercicio y la vitamina E en la mejora de la homeostasis de la glucosa, -los efectos combinados del ejercicio y la vitamina C sobre los factores de riesgo de la diabetes, -los efectos combinados del ejercicio y la vitamina E sobre el estatus lipoproteico y los factores de riesgo de enfermedades cardiovasculares.
Referencias bibliográficas
Ajmani RS et al. Oxidative stress and hemorheological changes induced by acute treadmill exercise. Clin Hemorheol Microcirc 2003;28(1):29-40.
Chevion S et al. Plasma antioxidant status and cell injury after severe physical exercise. Proc Natl Acad Sci U S A 2003; 100(9):5119-23.
Cooper EC et al. Exercise,free radicals and oxidative stress. Biochem Soc Trans. 2002;30(2):280-5. Review.
Dillard CJ et al. Effects of exercise, vitamin E, and ozone on pulmonary function and lipid peroxidation. J.Appl.Physiol (1978);45: 927-932.
Evans WJ. Vitamin E, vitamin C, and exercise. Am J Clin Nutr 2000;72(suppl):647S-52S.
Finkel T & Holbrook N. Oxidants, oxidative stress and the biology of ageing. Nature (2000); 408:239-247.
de Oliveira SL et al. Carbohydrate-energy restriction may protect the rat brain against oxidative damage and improve physical performance. Br J Nutr 2003;89(1):89-96.
Groussard C et al. Physical fitness and plasma non-enzymatic antioxidant status at rest and after a wingate test. Can J Appl Physiol 2003; 28(1):79-92.
Henriksen EJ, Saengsirisuwan V. Exercise training and antioxidants: relief from oxidative stress and insulin resistance. Exerc Sport Sci Rev 2003; 31(2):79-84.
Hoppeler H, Vogt M. Muscle tissue adaptations to hypoxia. J Exp Biol 2001 Sep; 204(Pt 18):3133-9.
Johnson P. Antioxidant enzyme expression in health and disease: effects of exercise and hypertension. Comp Biochem Physiol C Toxicol Pharmacol 2002; 133(4):493-505.
Ji LL Exercise-induced modulation of antioxidant defense. Ann N Y Acad Sci 2002;959:82-92.
Khassaf M et al. Effect of vitamin C supplements on antioxidant defence and stress proteins in human lymphocytes and skeletal muscle. J Physiol 2003 (sin publicar).
Konig D et al. Exercise and oxidative stress: significance of antioxidants with reference to inflammatory, muscular, and systemic stress. Exerc Immunol Rev 2001; 7:108-33.
Powers S, Lennon S. Analysis of cellular responses to free radicals: focus on exercise and skeletal muscle. Proceed Nutr Soc (1999); 58:1025-1033.
Sacheck JM, Blumberg JB. Role of vitamin E and oxidative stress in exercise. Nutrition. 2001;17(10):809-14. Review.
Sen CK. Antioxidants in exercise nutrition. Sports Med 2001; 31(13):891-908.
Tonkonogi M et al. Mitochondrial function and antioxidative defence in human muscle: effects of endurance training and oxidative stress Journal of Physiology (2000); 528.2: 379-388.
Vassilakopoulos T et al. Antioxidants attenuate the plasma cytokine response to exercise in humans. J Appl Physiol 2003; 94(3):1025-32.
Vesovic D et al. Strenuous exercise and action of antioxidant enzymes. Med Lav 2002;93(6):540-50.
| |
|
|---|---|
|
revista
digital · Año 9 · N° 66 | Buenos Aires, Noviembre 2003 |
|