
|
|||
|---|---|---|---|
|
|
Estresse oxidativo e suas implicações no portador de doença pulmonar obstrutiva crônica El estrés oxidativo y sus implicancias en el portador de la enfermedad pulmonar obstructiva crónica |
|
|
|
*Fisioterapeuta formada pelo Instituto de Ensino Superior de Itapira – IESI. **Mestranda em Ciências Médicas (UNICAMP). ***Doutor em Biologia Funcional e Molecular (UNICAMP) Coordenador de Graduação do curso de Bacharelado em Fisioterapia do Instituto de Ensino Superior de Itapira - IESI |
Patrícia Danisa Alves* Bruna Bergo Nader** Joaquim Maria Ferreira Antunes Neto*** (Brasil) |
|
|
|
Resumo A Doença Pulmonar Obstrutiva Crônica (DPOC) é uma doença progressiva e está relacionada a uma resposta inflamatória anormal dos pulmões devido à inalação de gases tóxicos ou partículas e também ao consumo do cigarro. O mecanismo central na gênese da DPOC é exacerbado devido aos danos nas estruturas pulmonares que os radicais livres e o estresse oxidativo causam no pulmão. O objetivo deste trabalho foi verificar através de uma revisão bibliográfica os principais conceitos sobre DPOC, o efeito do consumo do cigarro, as ações das espécies reativas de oxigênio (EROs) e a forma como atuam sobre as estruturas pulmonares provocando lesão tecidual significativa, bem como os mecanismos de defesa do nosso organismo. Dados literários que reforçam a importância desta temática na formação do fisioterapeuta indicam que os mecanismos responsáveis pelo desenvolvimento e manutenção do quadro clínico da DPOC são potencializados, sobretudo, pela ação do estresse oxidativo. Devido à exposição direta com o meio externo e a altas concentrações de oxigênio, os pulmões são alvos importantes dos danos causados pelos oxidantes. Considerando os procedimentos terapêuticos que elevam a entrada e retenção de O2 nos alvéolos (oxigenoterapia), há a necessidade de avaliar e mensurar o quanto de O2 é desejável para cada sujeito, uma vez que a dispersão do O2 na célula é a principal fonte de produção de EROs. Assim, o procedimento, que era para trazer resultados positivos, passa a ser um fator agravante na condição patológica do sujeito. Unitermos: Doença pulmonar obstrutiva crônica. Estresse oxidativo. Tratamento. Oxigenoterapia.
Recepção: 16/07/2014 - Aceitação: 26/09/2014.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires, Año 19, Nº 197, Octubre de 2014. http://www.efdeportes.com/ |
|
|
1 / 1
Introdução
A Doença Pulmonar Obstrutiva Crônica (DPOC) é um problema de saúde global, com graves repercussões econômicas e sociais, representa a quinta principal causa de morte no mundo e, de acordo com estimativas recentes, alcançará a terceira posição até o ano de 2030 (WHO, 2009), além de constituir-se, no plano individual, uma causa importante de incapacidade e de baixa qualidade de vida dos pacientes e de seus cuidadores (Pinto e colaboradores, 2007; Nunes e colaboradores, 2008).
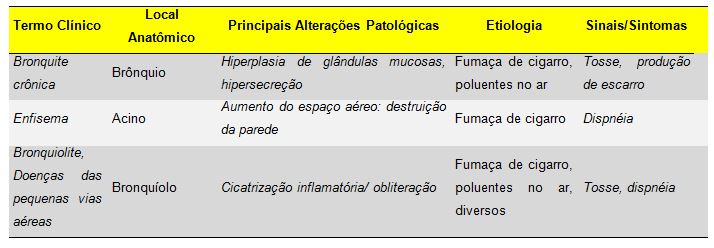
Segundo a Sociedade Brasileira de Pneumologia e Tisiologia (SBPT), a DPOC é uma enfermidade respiratória que pode ser prevenida e tratada, que se caracteriza pela presença de obstrução ou limitação crônica do fluxo aéreo, que apresenta progressão lenta e irreversível. A obstrução do fluxo aéreo é geralmente progressiva e está associada a uma resposta inflamatória anormal dos pulmões à inalação de partículas ou gases tóxicos (Barnes, 2000), causada primariamente pelo tabagismo. Embora a DPOC comprometa os pulmões, ela também produz conseqüências sistêmicas significativas. O processo inflamatório crônico pode produzir alterações dos brônquios - parênquima pulmonar (enfisema pulmonar) e bronquite crônica (Barnes, 2000; SBPT, 2004).
O enfisema pulmonar pode ser definido como um processo obstrutivo crônico, resultante de importantes alterações de toda estrutura distal do bronquíolo terminal, denominado ácino, levando ao acúmulo de ar nos pulmões, condição chamada de hiperinsuflação pulmonar (Barnes, 2000). Já a bronquite crônica é uma condição clínica caracterizada pelo excesso de secreção na árvore brônquica, tendo a presença de tosse crônica ou de repetição, junto com expectoração, por pelo menos três meses consecutivos do ano e em dois anos consecutivos (Gonzaga e colaboradores, 2005).
Os mecanismos responsáveis pelo desenvolvimento e manutenção do quadro clínico da DPOC são exacerbados principalmente pela ação do estresse oxidativo, induzido pela formação das espécies reativas de oxigênio (EROs). Devido à exposição direta com o meio externo e a altas concentrações de oxigênio, os pulmões são alvos importantes dos danos causados pelos oxidantes (Rajendrasozhan e colaboradores, 2008).
O tabagismo e geração de espécies reativas de oxigênio
Vários estudos indicam que o fumo induz forte papel na lesão pulmonar pelas EROs. Em comparação com sujeitos não fumantes, os fumantes crônicos mostram patamares mais elevados de produtos da oxidação dos lipídios das membranas celulares (Andrade Jr e colaboradores, 2005). Além disso, sujeitos que fumam apresentam níveis de marcadores antioxidantes reduzidos nos espaços alveolares quando comparados com não fumantes (Andrade Jr e colaboradores, 2005). A vitamina E é um grande antioxidante, por conta da sua estrutura. Nela, há uma região denominada tocoferol, a qual fica do lado de fora das membranas celulares (região hidrofílica). Quando o radical livre aproxima-se da membrana, este se liga ao tocoferol. Neste momento, a vitamina E se prende fortemente ao radical livre e o transporta para próximo das enzimas antioxidantes, funcionando como uma “captadora” deste agente tóxico. Desta forma, estudos consideram que a vitamina E seja a maior varredora de radicais livres no meio lipofílico. Há evidências, também, de que os leucócitos de fumantes liberam mais EROs (Bianchi, Antunes, 1999). Isso acontece pelo fato do O2 não conseguir se fixar efetivamente nos alvéolos dos fumantes, ficando livres na corrente sanguínea. Os leucócitos recrutam tais O2 e os transformam em radicais livres no seu interior. Vale a pena ressaltar que a forma que os leucócitos têm para a destruição de agentes nocivos é por meio de produção de EROs no seu interior. Como haverá um aumento de entrada de O2 pelo fato da patologia, isso potencializa a produção de EROs e deixa o ambiente interno alveolar mais suscetível aos ataques oxidativos (Antunes Neto, 2008).
A fumaça do cigarro eleva os níveis de EROs na via aérea humana (EI-Khatib, 2003), podendo induzir respostas inflamatórias e maior exposição de proteases (enzimas que podem destruir proteínas das membranas celulares), pela maior produção de EROs. O fenômeno é contrabalanceado por produção adequada de antiproteases, as quais tentam impedir a lesão das membranas alveolares. A produção insatisfatória de antiproteases (o que pode ocorrer no caso de sujeitos patológicos) pode não neutralizar as proteases ativadas pelo fumo, o que leva ao desencadeamento da DPOC (EI-Khatib, 2003). Um estudo interessante, em modelo animal, apresentou que a exposição de ratos à fumaça do cigarro provocou depleção (queda) de vitamina A, fato associado com o desenvolvimento de enfisema. O benzopireno, toxina presente na fumaça do cigarro, atua como o agente principal da queda dos níveis da vitamina A (Andrade Jr e colaboradores, 2005). Os carotenóides, desta forma, protegem lipídios contra a sua oxidação pelos radicais livres (Vannucchi e colaboradores, 1998).
Quadro 1. Distúrbios associados à obstrução do fluxo aéreo: o espectro
das doenças pulmonares obstrutivas crônicas (Robbins & Cotran 8ª Edição, 2010)
Estresse oxidativo e relação com doença pulmonar obstrutiva crônica
O termo estresse oxidativo é utilizado em circunstâncias nas quais o “desafio” por radicais livres resulta em dano tecidual ou na produção de compostos tóxicos ou danosos aos tecidos (Ferreira, Matsubara,1997).
Pode-se dizer que um organismo encontra-se em condição de estresse oxidativo quando ocorre um desbalanço entre os sistemas de ataque oxidativo e defesas antioxidantes (enzimáticos e não enzimáticos), de maneira que os primeiros sejam predominantes (Sies, 1986). Um dos principais mecanismos de lesão é a lipoperoxidação, ou seja, a oxidação da camada lipídica da membrana celular. Além disso, o estresse oxidativo pode gerar distúrbios em proteínas e ao DNA, provocando diversas alterações na função celular e, portanto, tecidual (Antunes Neto, 2012).
Quanto ao sistema respiratório, o estresse oxidativo é um dos principais responsável pelos danos diretos, potencializando os outros mecanismos participantes, a inflamação, o desequilíbrio do sistema protease-antiprotease e a apoptose (morte celular programada) (Cavalcante, 2009).
Dados literários que reforçam a importância desta temática na formação do fisioterapeuta indicam que os mecanismos responsáveis pelo desenvolvimento e manutenção do quadro clínico da DPOC são potencializados, sobretudo, pela ação do estresse oxidativo. Devido à exposição direta com o meio externo e a altas concentrações de oxigênio, os pulmões são alvos importantes dos danos causados pelos oxidantes (Rajendrasozhan e colaboradores, 2008).
Nos organismos aeróbios, o O2 é utilizado nas mitocôndrias como aceptor final de elétrons na cadeia respiratória, sendo reduzido a H2O no complexo IV. As quatro etapas de redução ocorrem no interior do complexo IV mitocondrial, liberando H2O como produto final da reação. A literatura documenta que cerca de 3-5% do O2 consumido é reduzido ao radical ânion superóxido (O2-), uma forma muito comum de formação de radicais livres nos meios biológicos.
Considerando a questão do DPOC, reações catalisadas pela xantina oxidase mostram-se uma fonte importante de radicais livres, pelo fato da condição de isquemia/reperfusão. O paciente que convive em situação de isquemia, por alterações severas nas estruturas alveolares, necessita de maior quantidade de energia (ATP) para manter-se ativo. As disfunções mitocondriais levam a degradação do ATP em seu metabólito final, o AMP (adenosina monofostato) e hipoxantina. Isso se dá por ativação potencializada da enzima xantina oxidase. Em situações normais a hipoxantina é degradada a ácido úrico. Porém, em baixas concentrações de O2, a enzima é transformada na sua forma oxidase, que utiliza O2 como aceptor de elétrons, produzindo também O2-no final do processo (Sjödin et al., 1990). Numa situação de grande inalação de O2, como no caso da oxigenoterapia, há também ativação abrupta da enzima xantina oxidase, o que leva, secundariamente, à formação de radicais livres. Como os radicais livres são espécies de alta instabilidade, atacam regiões celulares específicas, principalmente fosfolipídios de membranas celulares e subcelulares, proteínas e DNA nuclear e mitocondrial, com o objetivo de se estabilizar (Antunes Neto, 1998).
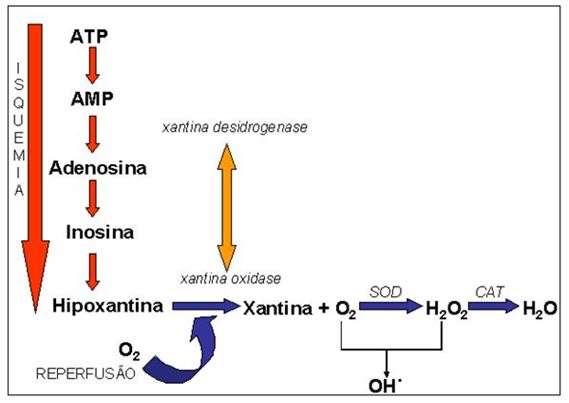
Figura 1. Mecanismos de formação de espécies reativas de oxigênio e as estratégias enzimáticas antioxidantes. Nota-se que o aumento de consumo de oxigênio
possibilita vazamento de elétrons na cadeia respiratória mitocondrial, o que potencializa a geração das espécies reativas. Enzimas como xantina oxidase, NADPH oxidase,
bem como os eventos decorrentes de processos inflamatórios (ativação leucocitária), contribuem para geração elevada dos radicais livres. Uma das vias musculares mais potentes
de geração de peróxinitrito é a degradação do aminoácido arginina, circunstância vista em condição de exercício exaustivo. Adaptado de Antunes Neto e colaboradores (2012).
As EROs podem ser desativadas por um conjunto de sistemas antioxidantes. Os principais sistemas de defesa endógenos compreendem as vitaminas antioxidantes (vitaminas A, C e E), ácido úrico, glutationa reduzida (GSH), grupamentos sulfidrila livres e enzimas antioxidantes (superoxido dismutase, catalase e sistema glutationa peroxidase/glutationa redutase) (Antunes Neto e colaboradores, 2011). As enzimas antioxidantes constituem o principal mecanismo de defesa antioxidante intracelular, pois eliminam O2.-, H2O2 e hidroperóxidos que poderiam oxidar os substratos celulares, prevenindo as reações em cadeia dos radicais livres, através da diminuição na concentração disponível destes para iniciar o processo (Yu, 1994).
A enzima superóxido dismutase (SOD), juntamente com a catalase (CAT) são as primeiras a serem ativadas no combate aos radicais livres, dismutando o radical O2-, formando H2O2 e O2- (Antunes Neto e colaboradores, 2005):
![]()
A outra enzima responsável pela detoxificação do H2O2, glutationa peroxidase (GPX), tem maior especificidade para esse substrato. Enquanto que a CAT atua somente quando há grande concentração de H2O2, a GPX colabora prontamente com a SOD neste processo (Antunes Neto e colaboradores, 2005):
![]()
A glutationa (GSH) é um tripeptídeo formado pelos aminoácidos glicina, cisteína e ácido glutâmico. Quando GSH é oxidada pela reação da GPX, há a interligação de duas moléculas do tripeptídeo por uma ponte dissulfeto, com formação de glutationa oxidada (GSSG). Queda nos níveis de GSH pode prejudicar as defesas celulares contra a ação tóxica dos radicais livres. As células íntegras mantêm uma razão GSH/GSSG alta. Para isso, a GSSG formada é reduzida novamente a GSH, às custas de NADPH, pela ação da enzima glutationa redutase (GR) (Antunes Neto e colaboradores, 2005):
![]()
Importante ressaltar que inúmeros trabalhos científicos mostram que o exercício físico pode elevar a atividade das enzimas antioxidante, sendo um instrumento fundamental para aumentar a função respiratória (Antunes Neto, 2003).
Fontes de radicais livres no pulmão
O pulmão é um importante alvo de danos causados por EROs, pelo fato de estar em contato direto e constante com o meio externo e exposto a elevados níveis de oxigênio (Rajendrasozhan e colaboradores, 2008; Park, Kim, Lee, 2009). Muitas das células do parênquima pulmonar são capazes de gerar EROs, como por exemplo, as células endoteliais, células alveolares tipo II, células clara, células ciliadas da via aérea, e os macrófagos alveolares (Andrade Jr e colaboradores, 2005).
Os agentes geradores de EROs no pulmão são muito semelhantes aos de outros tecidos. Observa-se que a relação dos EROs com danos pulmonares, a indução do processo isquemia/reperfusão (anóxia/reoxigenação) são correspondentes. Entretanto, no tecido pulmonar há uma diferença entre elas, pois o oxigênio está presente nos alvéolos durante a isquemia pulmonar. Nesta condição, o oxigênio alveolar ajuda a manter o metabolismo aeróbico, retardando a hipóxia (Cavalcante, Bruin, 2009).
Mas vale ressaltar que durante procedimentos terapêuticos que elevam a entrada e retenção de O2 nos alvéolos (oxigenioterapia), há a necessidade de avaliar e mensurar o quanto de O2 é desejável para cada sujeito, uma vez que a dispersão do O2 na célula é a principal fonte de produção de EROs. Assim, o procedimento, que era para trazer resultados positivos, passa a ser um fator agravante na condição patológica do sujeito.
Diferentemente de outros tecidos, os pulmões entram em contato com o oxigênio por duas vias: perfusão e ventilação. Hipóxia ou anóxia resultam em queda intensa dos níveis de ATP, com maior degradação desta molécula, levando ao aumento da produção de hipoxantina. Isso significa que a seguinte situação é instalada:
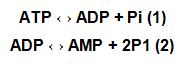
A quebra do ATP ocorre em situações onde seja favorável o restabelecimento desta molécula (1), no interior da mitocôndria, especificamente na cadeia transportadora de elétrons. No caso do paciente portador de DPOC, há grande dificuldade de introduzir o O2 no interior da mitocôndria, o que não possibilita a ressíntese do próprio ATP. A saída para a célula é continuar a degradar o composto que sobrou, que é o ADP. Isso ocorre por intermédio da ativação da enzima xantina oxidase (2), gerando como produto metabólico o AMP. Se já é uma tarefa tão complexa a ressíntese do ATP, imagine ter que restabelecer os níveis de um substrato pouco utilizado pela célula, que é o AMP. Para a célula, isso torna-se uma grande desvantagem, pois se gastaria muito mais energia do que em situação saudável! Além disso, com a reintrodução do oxigênio no meio através da reperfusão e/ou ventilação, forma-se o radical superóxido pela ação da xantina oxidase sobre a hipoxantina (Zhov e colaboradores,1997).
Estratégias de controle e intervenção terapêutica em sujeitos com risco potencial de DPOC
O exercício aeróbio é indicado e deve ser iniciado independentemente do estágio da DPOC (EI-Khatib, 2003). O treinamento aumenta a concentração de enzimas oxidativas mitocondriais, a capilarização dos músculos treinados, o limiar anaeróbio, o consumo máximo de oxigênio, e diminui o tempo de recuperação da creatina-fosfato, resultando em melhora da capacidade de exercício (Powers e colaboradores, 2000).
A adaptação ao treinamento físico é capaz de proteger os indivíduos treinados na maioria das situações de exposição ao exercício. O grau de estresse oxidativo e de dano muscular não depende da intensidade absoluta do exercício, mas do grau de exaustão da pessoa que realiza o exercício (Neder, 2001).
A fraqueza muscular é diretamente proporcional à perda de massa muscular (Dourado e colaboradores, 2006). Há estudos que comprovam que pacientes com DPOC apresentam redução significativa de força de membros superiores e inferiores quando são comparados com congêneres controles (Neder, 1997). Tendo em vista que a fraqueza muscular contribui para a intolerância ao exercício em portadores de doença pulmonar crônica, o exercício de força é uma opção racional no processo de reabilitação pulmonar (Dourado e colaboradores, 2006). Atualmente há evidências de que este treinamento pode resultar em melhora da qualidade de vida significativamente maior quando comparado com o exercício aeróbio (Puhan, 2005).
Embora os pesquisadores e profissionais da saúde discutam a importância da força muscular na capacidade funcional dos pacientes com DPOC, não há consenso com relação à implementação do treinamento de força nos programas de reabilitação pulmonar (Dourado e colaboradores, 2006).
Métodos terapêuticos
A oxigenoterapia é um tratamento em que a pressão parcial do oxigênio no sangue arterial é aumentada por meio de uma maior concentração de O2 no ar inspirado, com o objetivo de manter bons níveis de oxigenação em pacientes portadores da DPOC com exacerbações (EI-Khatib, 2003). Os pacientes que vivem com hipoxemia (baixa do teor de oxigênio no sangue) e, muitas vezes, hipercapnia (excesso de dióxido de carbono no sangue), apresentam um significativo comprometimento tanto físico, social e psíquico , com um comprometimento negativo na qualidade de vida, apresentando, ainda, repetidas complicações, que o conduzem a numerosas internações hospitalares. A oxigenoterapia consiste num tratamento em que a pressão parcial do oxigênio no sangue arterial (PaO2) é aumentada por meio de uma maior concentração de oxigênio no ar inspirado (Sousa, 2007). Esse tratamento demonstrou, em vários estudos efetuados, diminuir a hipertensão arterial, aumentar a tolerância ao esforço e reduzir o número de hospitalizações, melhorando, dessa forma, a qualidade de vida dos doentes respiratórios (Zeferino,2004).
A oxigenoterapia domiciliar prolongada é considerada, atualmente, o principal tratamento não farmacológico para portadores de DPOC e hipoxemia crônica. Outros benefícios adicionais também foram descritos com a ODP, como a melhora da função respiratória, prolongando a expectativa de vida e reduzindo internações (EI- Khatib, 2003).
Considerações finais
As EROs são moléculas que contém oxigênio e apresentam elétrons não pareados em sua órbita externa. Essa característica torna os EROs uma fonte de problemas para as células e tecidos, pois eles são capazes de reagir e modificar as estruturas moleculares de lípides, carbohidratos, proteínas. O próprio metabolismo celular pode gerar os EROs através da mitocôndria (principal geradora de EROs) e de fontes citoplasmáticas, mas a taxa de produção aumenta muito se os tecidos forem expostos a microambientes de hipóxia seguidos por reoxigenação (ou isquemia seguidos por reperfusão).Há um tempo mínimo de hipóxia/isquemia prévio à reoxigenação/reperfusão necessário para que se formem EROs em grande quantidade. Como os pulmões entram em contato com o oxigênio por duas vias diferentes, perfusão e ventilação, tornam-se alvos freqüentes dos EROs e muitas doenças pulmonares parecem ser influenciadas por essas moléculas. Há evidências da influência dos EROs nos danos teciduais das seguintes condições: tabagismo crônico, doença pulmonar obstrutiva crônica, entre outras. Há a necessidade de medir a quantidade de substancias oxidativas o paciente apresenta durante procedimentos terapêuticos que elevam a entrada e retenção de O2 nos alvéolos (oxigenioterapia), uma vez que a dispersão do O2 na célula é a principal fonte de produção de EROs. Assim, o procedimento, que era para trazer resultados positivos, passa a ser um fator agravante na condição patológica do sujeito.
Recentemente, relatos promissores de novas técnicas e métodos diagnósticos, bem como da identificação de potenciais alvos terapêuticos que permitam modificar, de fato, o curso clínico e o prognóstico da doença. Entre os novos métodos diagnósticos merece destaque a coleta do ar exalado. Trata-se de um método simples e não-invasivo, que permite a obtenção de material proveniente dos tecidos pulmonares para a detecção de marcadores da inflamação e do estresse oxidativo (Cavalcante, Bruin, 2009). É provável que, num futuro próximo, a determinação do nível de estresse oxidativo no pulmão passe a ser usada rotineiramente como um indicador das alterações patológicas que precedem a expressão clínico-funcional da DPOC.
Bibliografia
-
Antunes Neto, J. M. F. Estudo da relação entre estresse oxidativo e síntese de proteínas de estresse “HSP70” no sangue de animais submetidos a diferentes níveis de exercício físico. Universidade Estadual de Campinas: tese de doutorado. Instituto de Biologia, Departamento de Bioquímica, 2003.
-
Antunes Neto, J. M. F. Modificações morfofuncionais do tecido muscular induzidas pela atividade excêntrica: um estudo global dos processos adaptativos. Universidade Estadual de Campinas: dissertação de mestrado. Faculdade de Educação física. Departamento de Estudos da Atividade Física Adaptada, 1998.
-
Antunes Neto, J. M. F.; Pereira-da-Silva, L.; Macedo, D. V. Biomarcadores de estresse oxidativo: novas possibilidades de monitoramento em treinamento físico. Revista Brasileira de Ciência do Movimento, v. 13, p. 73-80, 2005.
-
Antunes Neto, J. M. F.; Nader, B. B.; Rivera, R. J. B.; Donadon, C. C.; Macedo, D. V. Marcadores fisiológicos de overtraining (parte 2): análise de um protocolo para ratos ‘wistar’ submetidos a treinamento de corrida intermitente. EFDeportes.com, Revista Digital. Buenos Aires, Año 17, Nº 171, Agosto de 2012. http://www.efdeportes.com/efd171/marcadores-fisiologicos-de-overtraining-2.htm
-
Antunes Neto, J. M. F.; Rivera, R. J. B.; Calvi, R, G.; Raffa, M. R.; Donadon, C. C.; Pereira, A. G.; Melo, P. S. Níveis comparativos de estresse oxidativo em camundongos em duas situações do limite orgânico: overreaching induzido por treinamento de natação e câncer. Revista Brasileira de Medicina do Esporte, v. 14, n. 6, p. 553-558, 2008.
-
Antunes Neto, J. M. F.; Paula, L. B. Índices de estresse oxidativo em sujeitos com diferentes níveis de composição corporal e aderência a prática de atividade física. Brazilian Journal of Biomotricity, v. 5, n. 2, p. 117-131, 2011.
-
Al Mehdi, A. B.; Schuman, H.; Fisher, A. B. Intracellular generation of reactive oxygen species during non hypoxic lung ischemia. American Journal of Physiology, v. 273, p. L294-L300, 1997.
-
Barnes, P. J. Chronic obstructive pulmonary disease. The New England Journal Medicine, v. 343, n. 4, p. 269-280, 2000.
-
Cavalcante, A. G. M.; Bruin, P. F. C. O papel do estresse oxidativo na DPOC: conceitos e atuais perspectivas. Jornal Brasileiro de Pneumologia, v. 35, n. 12, p. 1227-1237, 2009.
-
Date, H.; Matsumura, A.; Manchester, J. K.; Obo, H.; Lima, O.; Cooper, J. Evaluation of lung metabolism during successful twenty-four-hour canine lung preservation. Journal of Thoracic and Cardiovascular Surgery, v. 105, p. 480-491, 1993.
-
Dourado, V. Z.; Tanni, S. E.; Vale, S. A.; Faganello, M. M.; Sanchez, F. F.; Godoy, I. Manifestações sistêmicas na doença pulmonar obstrutiva crônica. Journal Brasileiro de Pneumologia, v. 32, n. 2, p. 161-171, 2006.
-
EI- Khatib, S. Biomarcadores de estresse oxidativo em fumantes crônicos e indivíduos portadores de insuficiência respiratória crônica (IResC) durante oxigenoterapia domiciliar prolongada (ODP). Universidade Estadual de Campinas: tese de doutorado. Instituto de Biologia, Departamento de Bioquímica, 2003.
-
Ferreira, A. L. A..; Matsubara, L. S. Radicais livres: conceitos, doenças relacionadas, sistema de defesa e estresse oxidativo Revista da Associação Médica Brasileira, v. 43, n. 1, p. 61-68, 1997.
-
Gonzaga, F. M. G.; Velloso, M.; Almeida, P. S. Análise do fisioterapeuta no paciente com bronquite crônica na fase hospitalar. In: IX Encontro Latino Americano de Iniciação Científica e V Encontro Latino Americano de Pós-Graduação, p. 1648-1651, 2005.
-
Vannucchi, H.; Moreira, E. A. M.; Cunha, D. F. Papel dos nutrientes na peroxidação lipídica e no sistema de defesa antioxidante Medicina. Simpósio de Nutrição Clínica (Ribeirão Preto), v. 31, p. 31-44, 1998.
-
Halliwell, B.; Gutteridge, J. M. Free radicals in biology and medicine. Oxford: Clarendon Press, 1989.
-
Kirkham, P.; Rahman, I. Oxidative stress in asthma and COPD: antioxidants as a therapeutic strategy. Pharmacology & Therapeutics, v. 111, n. 2, p. 476-494, 2006.
-
Moncada, S.; Higgs, A. Nitric oxide: role in human disease. Encyclopedia of Life Sciences, 2001. Disponível em: www.els.net em 20 dez 2001.
-
Neder, J. A.; Nery, L. E.; Cendon Filha, S. P.; Ferreira, I. M.; Jardim, J. R. Reabilitação pulmonar: fatores relacionados ao ganho aeróbio de pacientes com DPOC. Jornal de Pneumologia, v. 23, n. 3, p. 115-123, 1997.
-
Neder, J. A. Estratégias emergentes para o recondicionamento muscular esquelético na DPOC. In: Terra Filho, M.; Fernandes, A. L. G.; Stirbulov, R. (editores). Pneumologia: atualização e reciclagem. São Paulo: Vivali; 2001.
-
Nunes, D. M.; Mota, R. M.; Pontes Neto, O. L.; Pereira, E. D.; de Bruin, V. M.; de Bruin, P. F. Impaired sleep reduces quality of life in chronic obstructive pulmonary disease. Lung, v. 187, n. 3, p. 159-163, 2009.
-
Park, H. S.; Kim, S. R.; Lee, Y. C. Impact of oxidative stress on lung diseases. Respirology, v. 14, n. 1, p. 27-38, 2009.
-
Pinto, R. A.; Holanda, M. A.; Medeiros, M. M.; Mota, R. M.; Pereira, E. D. Assessment of the burden of caregiving for patients with chronic obstructive pulmonary disease. Respiratory Medicine, v. 101, n. 11, p. 2402-2408, 2007.
-
Powers, S. K.; Howley, E. T. Bioenergética. In: Powers, S. K.; Howley, E. T., editores. Fisiologia do exercício: teoria e aplicação ao condicionamento e ao desempenho, 3ª ed., São Paulo: Manole; 2000.
-
Puhan, M. A.; Schunemann, H. J.; Frey, M.; Scharplatz, M.; Bachmann, L. M. How should COPD patients exercise during respiratory rehabilitation? Comparison of exercise modalities and to treat skeletal muscle dysfunction. Thorax, v. 60, n. 5, p. 367-375, 2005.
-
Rajendrasozhan S, Yang SR, Edirisinghe I, Yao H, Adenuga D, Rahman I. Deacetylases and NF- kappaB in redox regulation of cigarette smoke-induced lung inflammation: epigenetics in pathogenesis of COPD. Antioxidants & Redox Signaling, v. 10, n. 4, p. 799-811, 2008.
-
Sies, H. Biochemistry of oxidative stress. Angewandte Chemie International Edition, v. 25, p. 1058-1071, 1986.
-
American Thoracic Society. Skeletal muscle dysfunction in chronic obstructive pulmonary disease. A Statement of the American Thoracic Society and European. American Journal of Respiratory and Critical Care Medicine, v. 159, n. 4, p. S2-S40, 1999.
-
Sociedade Brasileira de Pneumologia e Tisiologia. II Consenso Brasileiro sobre Doença Pulmonar Obstrutiva Crônica DPOC. Jornal de Pneumologia, v. 30, suppl. 5, p. S1-S42, 2004
-
SOUSA, A. M. S. A. Políticas de saúde e orçamento familiar: um estudo da oxigenoterapia domiciliar prolongada por uso de concentrador de oxigênio. Universidade Estadual do Ceará: dissertação de mestrado, 2008.
-
World Health Organization [homepage on the Internet]. Geneva: World Health Organization; c2009 [cited 2009 Jul 2]. World Health Report 2008. Available from: http://www.who.int/whr/2008/en/index.html
-
World Health Organization. Global Initiative for Chronic Obstructive Lung Disease. Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease updated. Washington: National Institutes of Health and National Heart, Lung, and Blood Institute; 2004.
-
Zeferino, M. T. Diretrizes para oxigenoterapia domiciliar. São Paulo: Farma Editores, 2004.
-
Zhov, G.; Al Mehdi, A. B.; Fischer, A. B. Anoxia - reoxygenation versus ischemia in isolated rat lungs. American Journal of Physiology, v. 273, p. L1112-1117, 1997.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista
Digital · Año 19 · N° 197 | Buenos Aires,
Octubre de 2014 |
|