
|
|||
|---|---|---|---|
|
|
Ação de compostos do Cerrado brasileiro como alvos fitoterápicos no combate ao câncer Acción de los compuestos del Cerrado brasileño como blancos a base de hierbas en la lucha contra el cáncer Roles of the Brazilian Cerrado compounds as phytotherapic targets in cancer treatment |
|
|
|
*Universidade Estadual de Montes Claros. Programa de Pós-Graduação em Ciências da Saúde **Faculdades Integradas Pitágoras de Montes Claros. Universidade Estadual de Montes Claros. Programa de Pós-Graduação em Ciências da Saúde ***Universidade Federal de Minas Gerais, Instituto de Ciências Biológicas. Departamento de Farmacologia Universidade Estadual de Montes Claros Programa de Pós-Graduação em Ciências da Saúde (Brasil) |
Deborah de Farias Lelis* Lucas Henrique Lopes Mendes de Figueiredo* João Marcus Oliveira Andrade* Danilo Cangussu Mendes* Marcos Vinícius Macedo de Oliveira** André Luiz Senna Guimarães* Sérgio Henrique Sousa Santos*** Alfredo Maurício Batista de Paula* |
|
|
|
Resumo O Cerrado é o segundo maior bioma brasileiro e apresenta diversos recursos naturais que são manejados para a prática da fitoterapia. Uma das grandes áreas de aplicação da fitoterapia é o tratamento de câncer, onde os compostos extraídos das plantas vêm sendo alvos de estudos que buscam identificar as vias pelas quais esses compostos atuam. O presente trabalho apresenta uma revisão integrativa com o objetivo de descrever alguns compostos com atividade fitoterápica antitumoral, produzidos por espécies do cerrado brasileiro, procurando abordar mecanismos e vias pelos quais eles atuam. Os compostos revisados neste estudo foram: piplartina, biflorina, KC-1, resveratrol, ácido gálico e o ácido clorogênico. Os compostos antitumorais, de uma forma geral, atuam no organismo sobre as proteínas reguladoras do ciclo celular, promovendo indução da apoptose, inibição da proliferação celular e inibição da metástases. Tais eventos são essenciais no desenvolvimento das neoplasias. Estudos buscando alvos que atuem no controle e regulação de mecanismos envolvendo a carcinogênese representam grande relevância para a identificação de terapias alternativas mais eficazes e menos invasivas ou, até mesmo, preventivas. Portanto, o presente trabalho mostra a importância de alguns compostos produzidos pela vegetação do cerrado brasileiro para as pesquisas com enfoque na medicina molecular. Unitermos: Cerrado. Fitoterapia. Atividade antitumoral.
Abstract Cerrado is the second largest Brazilian biome and presents many natural resources that are managed for the practice of phytotherapy. The compounds extracted from plants have been targeted in studies that aim to identify the pathways by which these compounds act. As one of the main areas of phytotherapy is cancer treatment, this paper presents an integrative review aiming to describe some herbal compounds with antitumor activity, produced by species of the Brazilian Cerrado, seeking to address roles and pathways thought which they act. The compounds reviewed in this study were: piplartin, biflorin, KC-1, resveratrol, gallic acid and chlorogenic acid. Antitumor compounds usually act on cell cycle regulatory proteins, promoting induction of apoptosis, inhibition of cell proliferation and metastasis. Such events are essential in the development of malignancies. Studies seeking targets that play roles in the control and regulation of mechanisms involving carcinogenesis represent great importance for the identification of more effective, less invasive or even preventive therapies. Thus, the current study showed the importance of some compounds produced by Brazilian Cerrado vegetation for researches focusing on molecular medicine. Keywords: Cerrado. Herbal medicine. Antitumor activity.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires - Año 19 - Nº 194 - Julio de 2014. http://www.efdeportes.com/ |
|
|
1 / 1
Introdução
O cerrado é o segundo maior bioma brasileiro, ocupando quase um quarto de todo o território nacional (figura 1), e atualmente, o Brasil e o mundo começam a se voltar para a riqueza desse bioma que abriga enorme variedade de recursos naturais para o uso humano uma vez que a rica biodiversidade do cerrado oferece diversos recursos naturais que são primorosamente manejados por suas populações para a prática da medicina popular. (Dias & Laureano, 2010)
Figura 1. Mapa com distribuição do bioma cerrado no Brasil
A fitoterapia teve início há milhares de anos através da observação do comportamento dos animais no processo da cura de doenças, e se refere ao tratamento de doenças mediante o uso de plantas. Dessa forma, as propriedades medicinais das plantas foram percebidas e então o uso destas para fins terapêuticos teve início, levando ao acúmulo de conhecimentos empíricos passados de geração para geração. (Ferro, 2006)
Uma das grandes áreas de aplicação da fitoterapia é o tratamento de câncer, uma vez que é uma doença de alta incidência e geralmente possui tratamentos pouco eficazes, onerosos e agressivos. A grande dificuldade no combate ao câncer é devida às limitações dos tratamentos cirúrgicos e/ou quimioterapêuticos, que muitas vezes não conseguem erradicar todas as células cancerosas presentes em um organismo, aumentando assim a possibilidade de recidivas e metástases dos tumores e diminuindo a possibilidade de cura. (Fraga et al., 2010, Johnson & Roberts, 2010) As células cancerosas apresentam diferenças moleculares que as tornam mais resistentes aos mecanismos de controle do ciclo celular e ainda tem a capacidade de driblar as respostas de defesa do organismo favorecendo o crescimento celular descontínuo e indução da angiogenese (Farias et al., 2010, Oliveira et al., 2010, Pereira et al., 2012, Oliveira et al., 2009, Fraga et al., 2012, Souza et al., 2010). Os estudos buscam então identificar essas alterações com o objetivo de tornar o tratamento mais efetivo, e com menor risco de recidivas, além de promover a redução dos efeitos colaterais. (Johnson & Roberts, 2010)
Muitos estudos vêm sendo conduzidos acerca de propriedades antitumorais exercidas por estes compostos em muitas espécies. Portanto, o presente trabalho apresenta uma revisão integrativa com o objetivo de descrever alguns compostos com atividade fitoterápica para o câncer, produzidos por espécies do cerrado brasileiro, procurando abordar mecanismos e vias pelos quais eles atuam. Os compostos revisados neste estudo são: piplartina, biflorina, KC-1, resveratrol, ácido gálico e o ácido clorogênico.
Piplartina
As espécies da família Piperaceae, pertencentes ao gênero Piper, com importantes representantes como a pimenta d’água (P. tuberculatum (Linnaeus)) e pimenta longa (P. Longum (Linnaeus)) (Costa-Lotufo et al., 2010) são plantas importantes na medicina tradicional, sendo utilizadas por exemplo no tratamento de asma, bronquite, febre, hemorróidas, doenças gastrointestinais e reumatismo. (Bezerra et al., 2006)
A piplartina é um alcalóide encontrado nas raízes das espécies pertencentes à família Piperaceae. Este composto vem sendo amplamente estudado, uma vez que apresenta atividade antifúngica, antiplaquetária, citotóxica, e antitumoral, sendo os efeitos citotóxicos e mutagênicos desse composto explicados por sua atuação sobre o DNA principalmente durante o período de crescimento celular (Bezerra et al., 2008).
Em um estudo in vitro, células PC-3 tratadas com piplartina por um período de 24 horas exibiram características de processo de apoptose, uma vez que as células sofreram retração, apresentando vacuolização, condensação da cromatina, fragmentação do DNA e núcleos picnóticos, além do aumento do número de células mortas. (Bezerra et al., 2007, Kong et al., 2008) Observou-se ainda diminuição dos níveis do cdc-2 (cell-division cycle 2), molécula envolvida na transcição entre as fases G2 e M, diminuição da expressão de proteínas anti-apoptóticas como bcl-2 (B-cell lymphoma), e um aumento significativo da clivagem da procaspase-3 e poli-polimerase (ADP-ribose), consequentemente levando a um aumento da atividade da caspase 3, que é uma proteína efetora essencial no desfecho do processo apoptótico (Bezerra et al., 2008).
Em adição, foi observado em outro teste um aumento na frequência de aberrações cromossômicas, diminuição da capacidade mitogenica e ausencia de células em metáfases passíveis de serem observadas (Bezerra et al., 2009) O composto em combinação com o diferuloylmethane, popularmente chamado de curumim, se mostrou bloqueando a ativação do receptor da tirosina quinase (Raf-1), diminuindo os níveis de ciclina D1 e cdk-2 (Cyclin-Dependent Kinase 2), conseqüentemente causando a estagnação da célula na fase G1. (Kong et al., 2008) Devido à atuação sobre tais proteínas envolvidas na regulação do ciclo celular, causando restrição direta do crescimento celular e ainda induzindo processo apoptótico demonstram o potencial da piplartina como piplartina como agente terapêutico para estudos com câncer.
Biflorina
Biflorina é um composto extraído das raízes da Capraria biflora Linnaeus (chá-da-terra), espécie da família Scrophulariaceae, presente no cerrado brasileiro. Essa planta possui algumas atribuições fitoquímicas na medicina, uma vez que suas folhas são usadas para o tratamento de dores, febres, diarréias, hemorróidas, reumatismo, entre outras. (Vasconcellos et al., 2005)
A biflorina foi usada em um estudo in vivo no tratamento de animais que tinham recebido previamente o transplante de células tumorais de Sarcoma 180 e carcinoma Ehrlich, onde se observou a diminuição do peso do tumor e redução das áreas com necrose coagulativa. Através da imunoistoquímica, menor número de células marcadas para o anticorpo Ki67 foi observado indicando um baixo índice de proliferação celular. (Vasconcellos et al., 2007). Em outro estudo, o potencial anti-proliferativo da biflorina foi novamente demonstrado, uma vez que o composto induziu consideráveis danos ao DNA, fator importante para limitação do potencial proliferativo das células. (Vasconcellos et al., 2010)
A espécie Capraria biflora pode ser então considerada um importante agente anticâncer, já que tem como uma de suas atividades a capacidade de quebrar as fitas de DNA induzindo a célula a um processo apoptótico. (Komarasamy & Sekaran, 2012, Vasconcellos et al., 2010)
KC-1
Kielmeyera coriaceae Mart. & Zucc. (pau-santo), é uma espécie do gênero Kielmeyera, e da família Clusiaceae, encontrada no cerrado e listada em vários estudos como planta medicinal. (Rodrigues & Carvallho, 2001, Santos & Felfili, 2006)
A partir da casca da raiz de K. coriaceae, obteve-se um extrato ao qual se deu o nome de KC-1, composto este, constituído da mistura delta tocotrienol e seu peróxido dímero. Foi observada a atividade do composto KC-1 sobre quatro linhagens de câncer humano (HL-60; HCT-8; MDA-MB-435; SF-295) onde os resultados mostraram significativa supressão do crescimento celular. Análise de viabilidade celular pela técnica “Exclusão por Azul de Tripan” em celulas da linhagem HL-60 traradas com o composto mostrou um aumento significativo de células não-viáveis. A técnica de “Incorporação de BrdU (5-bromo-2'-deoxiuridina)” demonstrou inibição de 95,9% da incorporação deste nucleosídeo sintético em células tratadas, revelando inibição da síntese de DNA. A análise morfológica por coloração em H&E (hematoxilina e eosina) mostrou células em processo apoptótico, apresentando entre outras características condensação da cromatina e fragmentação do núcleo. Ainda, quebra da integridade da membrana nas maiores concentrações, além de diminuição do volume celular e condensação do núcleo, sendo ambas modificações morfológicas compatíveis com células apoptóticas, foram observadas através do estudo da integridade da membrana celular por citometria de fluxo. (Laundry, 2009)
Observa-se, portanto, que o composto KC-1 possui importantes atividades biológicas nas células, podendo vir a ser usado nas terapias anti-câncer, uma vez que induz apoptose, reduzindo o tamanho tumoral e diminuindo a proliferação celular. Por outro lado, ele também pode exercer efeitos adversos como a propriedade de provocar morte celular em células não-cancerosas.
Resveratrol
O resveratrol é uma fitoalexina encontrada em algumas espécies de plantas do cerrado como o Kashuwu (Polygonum multiflorum Thunb.), o Kojo-kon (Polygunum cuspidatum Siebold & Zucc.) e, principalmente, nas uvas (Vitis vinefera (Linnaeus) e Vitis labrusca (Linnaeus)). (Sautter et al., 2005)
O resveratrol age como agente antitumoral através da inibição direta e indireta da proteína mTOR (alvo da rapamicina em mamíferos), impedindo o crescimento celular e estimulando a autofagia da célula. A mTOR é uma quinase que, junto a outras proteínas, forma complexos (TORC1 e TORC2) reguladores da síntese proteica e de proteínas anti-autofágicas. O resveratrol pode atuar tanto na fosforilação da subunidade da mTOR p70, impedindo a formação dos complexos reguladores, quanto na inibição de proteínas de sinalização da atividade da mTOR, como a proteína quinase B (PKB), a qual é estimulada pela PI3-quinase (fosfatidilinositol 3-quinase) uma proteína-quinase cuja atividade é induzida por estímulos externos. (Sridharan et al., 2011, Zhang et al., 2012)
As proteínas da família das metaloproteinases de matriz (MMP) são codificadas pelo gene MMP e estão envolvidas na quebra de matriz extracelular em processos fisiológicos normais, como no desenvolvimento embriológico ou na remodelagem de um tecido, bem como em processos patológicos, como na metástase. A MMP9 e a MMP2 estão envolvidas nas propriedades invasivas dos cânceres humanos. (Fraga et al., 2012) A sua produção é regulada por vários tipos de citocinas, como o NF-κβ (fator nuclear kappa beta), que age como fator de transcrição desse gene, além de xenobióticos, como por exemplo o PAM (forbol-12-miristato 13-acetato). (Kim et al., 2012)
Dessa forma, o resveratrol age como agente antitumoral através da inibição das MMPs, através de três vias distintas: (I) suprimindo a atividade da MMP9 diretamente; (II) inibindo PAM, suprimindo indiretamente a produção e a atividade enzimática da MMP9; (III) inibindo a formação de espécies reativas de oxigênio (ROS), as quais normalmente degradam o IκBα ( subunidade inibitória do NF-κβ), o que causará diminuição do NF-κβ (Reuter et al., 2010) e, consequentemente, a redução transcricional da MMP9. (Kim et al., 2012)
O resveratrol age também através da ativação das sirtuinas que por sua vez participam do controle do ciclo celular, bem como do processo apoptótico da célula e estão fortemente envolvidas na regulação da expressão de genes associados com diversas funções metabólicas na célula. A Sirt1(desacetilase NAD-dependente sirtuina 1) é o membro mais estudado da família das sirtuinas em humanos, agindo através da desacetilação de várias proteínas na célula. Dentre elas, pode-se citar a proteína RelA/p65 (Yeung et al., 2004), uma subunidade do complexo NF-κβ inibindo a transcrição de proteínas do gene BIRC3, também conhecido como cIAP2 (inibidor celular de apoptose). Esse gene codifica proteínas da família das IATs (proteínas inibidoras da apoptose), que agem inibindo a atividade de várias proteínas apoptóticas, dentre elas, caspases efetoras da via de apoptose induzida por TNF-α (fator de necrose tumoral alfa), inibindo-a. Dessa forma, o resveratrol, por meios ainda pouco conhecidos e elucidados na literatura, estimula a síntese e a ação de sirtuinas, principalmente a Sirt1, promovendo a apoptose celular e inibindo a proliferação do tumor. (Pradhan et al., 2012, Yeung et al., 2004) Os mecanismos de ação do resveratrol descritos estão resumidamente esquematizados na figura 2.
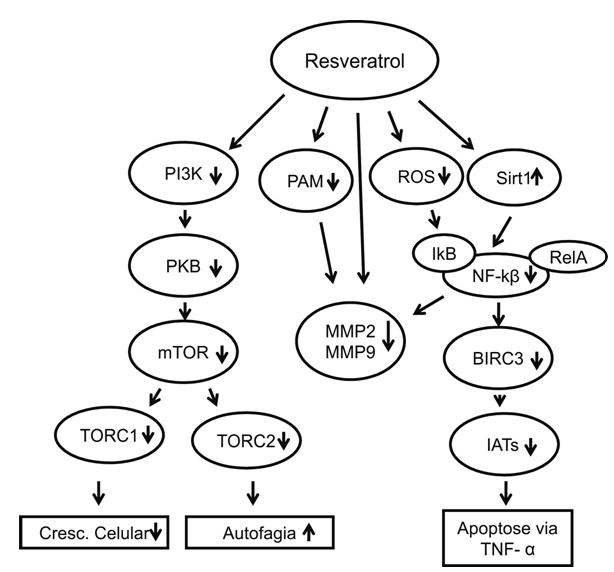
Figura 2. Vias de atividade do Resveratrol
Ácido Gálico
O ácido gálico, conhecido quimicamente como ácido 3,4,5-triidróxi-benzóico, é um polifenol com atividade anti-oxidante encontrado em algumas espécies do cerrado como no caraguatá (Bromelia balansae Mez) e no tarumã (Vytex cymosa Bert.). Mesmo tendo sido reconhecido que as plantas, bactérias e fungos estejam envolvidos na sua formação, a síntese do ácido gálico ainda não é totalmente compreendida, porém, sabe-se que sua produção envolve a rota biosintética do ácido chiquímico. (Muir et al., 2011)
Assim como descrito para o resveratrol, o ácido gálico atua impedindo a migração e a metástase do tumor através da inibição da síntese das MMPs (MMP2 e MMP9). Isso ocorre pela inibição de vias, as quais estimulam a expressão do gene dessas proteínas. O ácido gálico atua inibindo três dessas vias. (Liao et al., 2012, Liu et al., 2011, Lo et al., 2011)
O ácido gálico pode atuar inibindo diretamente a proteína Ras responsável por ativar o módulo MAP-quinase, que por sua vez estimula a proteína Raf levando a ativação de Erk. A proteína Erk por sua vez ativa diversas proteínas responsáveis pela regulação de expressões gênicas, como por exemplo MMP2 e MMP2 e pela divisão e diferenciação celular (Johnson & Roberts, 2010) (Lo et al., 2011).
Outra forma de impedir a produção das MMPs é através da inibição do fator de crescimento de proteína GRB2O, interferindo na ação da IKK, proteína responsável por ativar indiretamente o complexo protéico NF-κβ, afetando a síntese da MMP2 e da MMP9 (Liao et al., 2012).
PI3-quinase/PKB é outra via pelo qual o ácido gálico ainda atua afetando a síntese de proteínas como por exemplo MMP2 e MMP9, já descritas por sua importância na diferenciação e no crescimento celular, ou inibindo a GRB2, que por sua vez inibe a PI3-quinase, desestimulando a síntese dessas MMPs. (Liu et al., 2011)
Ademais, o ácido gálico pode agir pela estimulação da apoptose, inibindo o crescimento do tumor. Isso ocorre também pela sua ação inibitória sobre a proteína Ras, uma vez que esta estimula proteinas como mTOR e a PI3-quinase. A PI3-quinase, além da sua participação na expressão das MMPs, também participa da atividade anti-apoptótica da célula, ativando a PKB, estimulando a apoptose através da inibição de proteínas anti-apoptóticas (Bcl-2 e Bcl-x). (Zhangfeng et al., 2012) A mTOR, já elucidada anteriormente, forma complexos reguladores do crescimento celular e inibidores da apoptose. Dessa forma, por inibição da Ras, o ácido gálico inibe essas vias, estimulando a morte das células carcinogênicas. (Johnson & Roberts, 2010, Liao et al., 2012) Os mecanismos de ação do ácido gálico descritos estão resumidamente esquematizados na figura 3.
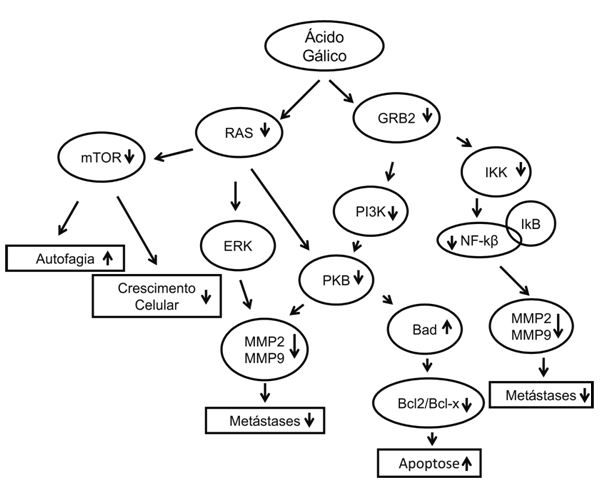
Figura 3. Vias de atividade do Ácido Gálico
Ácido Clorogênico
O ácido clorogênico é um dos polifenois mais abundantes na dieta humana, sendo encontrado profusamente nos grãos de café. No cerrado ele pode ser encontrado em algumas frutas, como na semente e na casca de araticum (Annona crassiflora Mart), na casca de pequi (Caryocar brasiliense Cambess) e na semente de cagaita (Eugenia dysenterica Mart). Ele é enquadrado na família dos ésteres e pertence a um grupo de agentes antioxidantes. (Feng et al., 2005, Mccarthy, 2012) Estudos demonstram divergências nas ações do ácido clorogênico, já que, ao mesmo tempo em que ele induz efeitos genotóxicos, podendo estar envolvido com o aumento do risco de desenvolvimento de alguns tipos de câncer (Arab, 2010, Higdon & Frei, 2006), apresenta atividade antioxidante, diminuindo o risco de doenças crônicas, além de exercer efeito antitumoral através da inibição de vias que induzem a proliferação celular. (Feng et al., 2005)
É conhecido que a ativação da AP-1 (apoproteína 1) e do NF-κβ têm efeitos promotores de tumor através da propriedade de induzir a expressão de genes alvos em diversos processos de malignidades. Essas proteínas atuam como fatores de transcrição, alterando a síntese de proteínas diretamente ligadas a processos malignos como: progressão de tumor, transformação neoplásica e até mesmo em processos inflamatórios. Uma vez que espécies reativas de oxigênio ativam NF-κβ e MAPKs e consequentemente AP-1, o ácido clorogênico impede o estresse oxidativo das células cancerígenas pela inibição de ROS, cessando as transformações neoplásicas que são estimuladas por essas proteínas nas células (Rakshit et al., 2010) (Feng et al., 2005).
Pesquisas comprovam a ação do ácido clorogênico como um inibidor da bcr-abl-quinase, desencadeando a apoptose de células leucêmicas através da via de ativação da proteína MAPK p38, inibida pela bcr-abl-quinase. É conhecido que a p38 tem um papel importante como promotor da apoptose, entretanto, a forma como essa proteína ativa esse processo ainda não é totalmente esclarecida (Bandyopadhyay et al., 2004) Conclui-se, dessa forma, que o ácido clorogênico apresenta propriedades inibitórias do crescimento celular das células cancerígenas na LMC. (Rakshit et al., 2010) Os mecanismos de ação do ácido clorogênico descritos estão resumidamente esquematizados na figura 4.
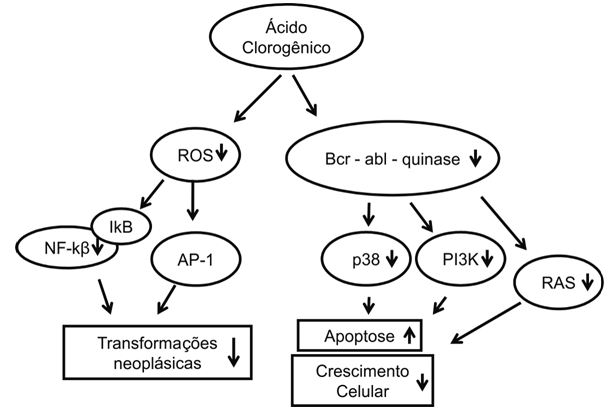
Figura 4. Vias de atividade do Ácido Clorogênico
Conclusão
A busca pelo desenvolvimento de novas drogas e terapias anticâncer foram incrementadas com a inclusão de drogas naturais como possíveis formas de combater essa doença.
Os compostos citados nesta revisão apresentam diferentes atividades antitumorais. Contudo, algumas espécies citadas são pouco relatadas na literatura, tornando necessário um aprofundamento nos estudos que busquem elucidar ainda mais as atividades biológicas exercidas por elas. O presente estudo chama atenção para o grande potencial dos fitoterápicos no combate ao câncer, além de reforçar a necessidade de preservação dos biomas brasileiros, importantes fontes de recursos para a pesquisa e a medicina popular.
Estes e outros estudos demonstram o grande potencial das plantas do cerrado para o uso na medicina, uma vez que muitas substâncias extraídas dessas espécies agem de forma benéfica à saúde do ser humano. Tornam-se, então, muito importantes os estudos in vivo e in vitro dessas substâncias para a elucidação dos mecanismos de ação das atividades biológicas por elas exercidas, pois é através delas que a exploração desses recursos poderão ser usados de forma segura e eficaz no tratamento de doenças.
Referências
-
Arab L. Epidemiologic evidence on coffee and cancer. Nutr Cancer. 2010;62(3):271-83.
-
Bandyopadhyay G, Biswas T, Roy KC, Mandal S, Mandal C, Pal BC, et al. Chlorogenic acid inhibits Bcr-Abl tyrosine kinase and triggers p38 mitogen-activated protein kinase-dependent apoptosis in chronic myelogenous leukemic cells. Blood. 2004 Oct 15;104(8):2514-22.
-
Bezerra DP, Castro FO, Alves AP, Pessoa C, Moraes MO, Silveira ER, et al. In vivo growth-inhibition of Sarcoma 180 by piplartine and piperine, two alkaloid amides from Piper. Brazilian journal of medical and biological research = Revista brasileira de pesquisas medicas e biologicas / Sociedade Brasileira de Biofisica [et al]. 2006 Jun;39(6):801-7.
-
Bezerra DP, De Castro FO, Alves AP, Pessoa C, De Moraes MO, Silveira ER, et al. In vitro and in vivo antitumor effect of 5-FU combined with piplartine and piperine. Journal of applied toxicology : JAT. 2008 Mar;28(2):156-63.
-
Bezerra DP, Militao GC, De Castro FO, Pessoa C, De Moraes MO, Silveira ER, et al. Piplartine induces inhibition of leukemia cell proliferation triggering both apoptosis and necrosis pathways. Toxicology in vitro : an international journal published in association with BIBRA. 2007 Feb;21(1):1-8.
-
Bezerra DP, Moura DJ, Rosa RM, De Vasconceloss MC, Silva AC, De Moraes MO, et al. Evaluation of the genotoxicity of piplartine, an alkamide of Piper tuberculatum, in yeast and mammalian V79 cells. Mutation research. 2008 Apr 30;652(2):164-74.
-
Bezerra DP, Vasconcellos MC, Machado MS, Villela IV, Rosa RM, Moura DJ, et al. Piplartine induces genotoxicity in eukaryotic but not in prokaryotic model systems. Mutation research. 2009 Jun-Jul;677(1-2):8-13.
-
Costa-Lotufo LV, Montenegro RC, Alves APNN, Madeira SVF, Pessoa C, Moraes MEA, et al. A Contribuição dos Produtos Naturais como Fonte de Novos Fármacos Anticâncer: Estudos no Laboratório Nacional de Oncologia Experimental da Universidade Federal do Ceará. Rev Virtual Quim. 2010;2(1):47-58.
-
Oliveira MV, Fraga CA, Gomez RS, Paula AM. Immunohistochemical expression of interleukin-4, -6, -8, and -12 in inflammatory cells in surrounding invasive front of oral squamous cell carcinoma. Head & neck. 2009 Nov;31(11):1439-46.
-
Dias JE, Laureano LC. Farmacopéia Popular do Cerrado 2010. 42 p.
-
Farias LC, Fraga CAC, Oliveira MVM, Silva TF, Marques-Silva L, Moreira PR, De-Paula AMB, Gomez RS, Guimarães ALS. Effect of age on the association between p16CDKN2A methylation and DNMT3B polymorphism in head and neck carcinoma and patient survival. . International Journal of Oncology. 2010;37(1):167-76.
-
Feng R, Lu Y, Bowman LL, Qian Y, Castranova V, Ding M. Inhibition of activator protein-1, NF-kappaB, and MAPKs and induction of phase 2 detoxifying enzyme activity by chlorogenic acid. J Biol Chem. 2005 Jul 29;280(30):27888-95.
-
Ferro D. Fitoterapia: Conceitos Clínicos. 1 ed. São Paulo2006.
-
Fraga CAC, Oliveira MVM, De Oliveira ES, Barros LO, Santos FB, Gomez RS, De-Paula AMB, Guimarães ALS. A high HIF-1alpha expression genotype is associated with poor prognosis of upper aerodigestive tract carcinoma patients. Oral oncology. 2012 Feb;48(2):130-5.
-
Fraga CAC, Oliveira MVM, Domingos PLB, Botelho AC, Guimaraes AL, Teixeira-Carvalho A, Correa-Oliveira R, De-Paula AMB. Infiltrating CD57+ inflammatory cells in head and neck squamous cell carcinoma: clinicopathological analysis and prognostic significance. Applied immunohistochemistry & molecular morphology : AIMM / official publication of the Society for Applied Immunohistochemistry. 2012 May;20(3):285-90.
-
Fraga CAC, Oliveira MVM, Oliveira ES, Barros LO, Domingos PLB, Gomes EPP, De-Paula AMB, Guimarães ALS. Prognostic value of intratumoral CD57+T cells and microvessel density in head and neck squamous cell carcinoma. Archives of Oral Research. 2010;6(1):35-45.
-
Higdon JV, Frei B. Coffee and health: a review of recent human research. Crit Rev Food Sci Nutr. 2006;46(2):101-23.
-
Johnson AL, Roberts RW. Biologia Molecular da Célula. 5° ed2010. 1256-7 p.
-
Johnson AL, Roberts RW. Biologia Molecular da Célula. 5º ed2010. 2 p.
-
Kim YS, Sull JW, Sung HJ. Suppressing effect of resveratrol on the migration and invasion of human metastatic lung and cervical cancer cells. Mol Biol Rep. 2012 Sep;39(9):8709-16.
-
Komarasamy TV, Sekaran SD. The Anti-proliferative Effects of a Palm Oil-derived Product and Its Mode of Actions in Human Malignant Melanoma MeWo Cells. Journal of oleo science. 2012;61(4):227-39.
-
Kong EH, Kim YJ, Cho HJ, Yu SN, Kim KY, Chang JH, et al. Piplartine induces caspase-mediated apoptosis in PC-3 human prostate cancer cells. Oncology reports. 2008 Oct;20(4):785-92.
-
Laundry MM. Potencial antitumoral de substâncias isoladas de plantas do Cerrado Brasileiro: estudos preliminares do mecanismo de ação da atividade citotóxica. Brasília-DF: Universidade de Brasília; 2009.
-
Liao CL, Lai KC, Huang AC, Yang JS, Lin JJ, Wu SH, et al. Gallic acid inhibits migration and invasion in human osteosarcoma U-2 OS cells through suppressing the matrix metalloproteinase-2/-9, protein kinase B (PKB) and PKC signaling pathways. Food Chem Toxicol. 2012 May;50(5):1734-40.
-
Liu KC, Huang AC, Wu PP, Lin HY, Chueh FS, Yang JS, et al. Gallic acid suppresses the migration and invasion of PC-3 human prostate cancer cells via inhibition of matrix metalloproteinase-2 and -9 signaling pathways. Oncology reports. 2011 Jul;26(1):177-84.
-
Lo C, Lai TY, Yang JS, Yang JH, Ma YS, Weng SW, et al. Gallic acid inhibits the migration and invasion of A375.S2 human melanoma cells through the inhibition of matrix metalloproteinase-2 and Ras. Melanoma Res. 2011 Aug;21(4):267-73.
-
Mccarthy AA. Structure and function of hct from coffee. Plan Physiology Preview. 2012.
-
Muir RM, Ibanez AM, Uratsu SL, Ingham ES, Leslie CA, Mcgranahan GH, et al. Mechanism of gallic acid biosynthesis in bacteria (Escherichia coli) and walnut (Juglans regia). Plant molecular biology. 2011 Apr;75(6):555-65.
-
Oliveira MVM, Fraga CAC, Pereira CS, Barros LO, Oliveira ES, Guimaraes ALS, De-Paula AMB. Field Cancerization in Head and Neck Squamous Cell Carcinoma: immunohistochemical expression of p53 and Ki67 proteins and clinicopathological study.Archives of Oral Research. 2010;6(1):17-27.
-
Pereira CS, Oliveira MV, Fraga CA, Barros LO, Domingos PL, Roy A, De-Paula AMB, Guimaraes ALS. Impact of the epithelial dysplasia grading and Ki67 proliferation index in the adjacent non-malignant mucosa on recurrence and survival in head and neck squamous cell carcinoma. Pathology, research and practice. 2012 Sep 17.
-
Pradhan M, Baumgarten SC, Bembinster LA, Frasor J. CBP mediates NF-kappaB-dependent histone acetylation and estrogen receptor recruitment to an estrogen response element in the BIRC3 promoter. Molecular and cellular biology. 2012 Jan;32(2):569-75.
-
Rakshit S, Mandal L, Pal BC, Bagchi J, Biswas N, Chaudhuri J, et al. Involvement of ROS in chlorogenic acid-induced apoptosis of Bcr-Abl+ CML cells. Biochemical pharmacology. 2010 Dec 1;80(11):1662-75.
-
Reuter S, Gupta SC, Chaturvedi MM, Aggarwal BB. Oxidative stress, inflammation, and cancer: how are they linked? Free Radic Biol Med. 2010 Dec 1;49(11):1603-16.
-
Rodrigues VEG, Carvallho DA. Levantamento etnobotânico de plantas medicinais do domínio do cerrado na região do alto rio grandee - Minas Gerais. Ciência e Agrotecnologia. 2001;25(1):102-23.
-
Santos DS, Felfili MJ. Uso de plantas medicinais na região de Alto Paraíso de Goiás, GO, Brasil. Acta Botanica Brasilica. 2006 2005;20(1):135-42.
-
Sautter CK, Denarin S, Alves AO, Mallann CA, Penna NG, Hecktheuer LH. Determinação de resveratrol em sucos de uva no Brasil. Ciênc Tecnol Aliment. 2005;25:437-42.
-
Souza LR, Fonseca-Silva T, Santos CC, Oliveira MV, Correa-Oliveira R, Guimaraes AL, De-Paula AMB. Association of mast cell, eosinophil leucocyte and microvessel densities in actinic cheilitis and lip squamous cell carcinoma. Histopathology. 2010;57(6):796-805.
-
Sridharan S, Jain K, Basu A. Regulation of autophagy by kinases. Cancers. 2011;3:2630-54.
-
Vasconcellos MC, Bezerra DP, Fonseca AM, Pereira MR, Lemos TL, Pessoa OD, et al. Antitumor activity of biflorin, an o-naphthoquinone isolated from Capraria biflora. Biological & pharmaceutical bulletin. 2007 Aug;30(8):1416-21.
-
Vasconcellos MC, Montenegro RC, Miilitao GC, Fonseca AM, Pessoa OD, Lemos TL, et al. Bioactivity of biflorin, a typical o-naphthoquinone isolated from Capraria biflora L. Zeitschrift fur Naturforschung C, Journal of biosciences. 2005 May-Jun;60(5-6):394-8.
-
Vasconcellos MC, Moura DJ, Rosa RM, Machado MS, Guecheva TN, Villela I, et al. Evaluation of the cytotoxic and antimutagenic effects of biflorin, an antitumor 1,4 o-naphthoquinone isolated from Capraria biflora L. Archives of toxicology. 2010 Oct;84(10):799-810.
-
Yeung F, Hoberg JE, Ramsey CS, Keller MD, Jones DR, Frye RA, et al. Modulation of NF-kappaB-dependent transcription and cell survival by the SIRT1 deacetylase. The EMBO journal. 2004 Jun 16;23(12):2369-80.
-
Zhang X, Chen LX, Ouyang L, Cheng Y, Liu B. Plant natural compounds: targeting pathways of autophagy as anti-cancer therapeutic agents. Cell Prolif. 2012 Jul 6.
-
Zhangfeng Z, Yuanye D, Ywgylb X, Tb W, Jingrong C, Qingwen Z, et al. Furanodiene, a Natural Product, Inhibits Breast Cancer Growth Both in vitro and in vivo. Cellular Physiology and Biochemistry. 2012;30:778-90.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista Digital · Año 19 · N° 194 | Buenos Aires,
Julio de 2014 |
|