
|
|||
|---|---|---|---|
|
|
Imunolocalização dos marcadores p53, Bcl-2 e Ki-67 em lesões Inmunolocalización de los marcadores p53, Bcl-2 y Ki-67 en lesiones de carcinoma nasofaríngeo: su relación con aspectos clinicopatológicos y epidemiológicos |
|
|
|
*Biólogo. Mestrado em Ciências da Saúde Universidade Estadual de Montes Claros, Montes Claros **Médica. Especialista em Oncologia Clínica Universidade Estadual de Montes Claros, Montes Claros ***Professor Faculdades Integradas Pitágoras de Montes Claros ****Professor do Programa de Pós-graduação em Ciências da Saúde Universidade Estadual de Montes Claros, Montes Claros (Brasil) |
Lucas Oliveira Barros* Cláudia Cristina Teixeira Alves Cangussu** Marcos Vinícius Macedo de Oliveira*** Camila Santos Pereira* Alfredo Maurício Batista De-Paula**** |
|
|
|
Resumo O presente estudo teve como objetivo avaliar a imunolocalização das proteínas que influenciam os fenômenos de controle do ciclo celular, a proteína p53, Bcl-2 e o Ki-67 no Carcinoma Nasofaríngeo (CN) e buscar associação entre os dados encontrados com fatores epidemiológicos, clínicos e morfológicos. O grupo estudado foi de quatorze casos de CN dos serviços de oncologia de referência para o tratamento do câncer de Montes Claros - Minas Gerais, Brasil. Associações entre as médias da contagem da imunoistoquímica da p53, Bcl-2 e Ki-67 com parâmetros clinicopatológicos e epidemiológicos foram realizadas pelo teste ANOVA. Nossos resultados mostram que não houve associação significativa entre a imunoexpressão das proteínas com parâmetros clinicopatológicos e dados epidemiologicos. Unitermos: Imunoistoquímica. Reparo do DNA. Apoptose. Proliferação.
Abstract The present study aimed to evaluate the immunolocalization of proteins that play roles over the cell cycle control, p53, Bcl-2 and Ki-67 in Nasopharyngeal Carcinoma (NC) and seek association with epidemiological, clinical and morphological factors. Fourteen NC cases were selected from oncology reference services to cancer treatment at Montes Claros - Minas Gerais, Brazil. Associations between the mean score of the p53, Bcl-2 and Ki-67 with clinicopathological parameters and epidemiological were performed by ANOVA. Our results show no significant association between immunostaining of proteins with clinicopathologic parameters and epidemiological data. Keywords: Immunohistochemistry. DNA repair. Apoptosis. Proliferation.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires, Año 18, Nº 183, Agosto de 2013. http://www.efdeportes.com |
|
|
1 / 1
Introdução
A nasofaringe é uma região localizada atrás da cavidade nasal e acima da orofaringe (28). O Carcinoma Nasofaríngeo (CN) é uma neoplasia maligna que se origina do epitélio da nasofaringe (54), as neoplasias da nasofaringe são doenças muito graves por apresentarem um comportamento biológico peculiar e muito agressivo (6). São lesões oligossintomáticas que apresentam uma capacidade de metastatização linfática locorregional precoce (13). O número e volume de metástases não estão proporcionalmente ligados ao tamanho do tumor primário, sendo encontradas lesões primárias muito pequenas associadas a volumosas metástases cervicais bilaterais (23).
O gene TP53 e seu produto protéico são controladores do crescimento normal e da homeostase de células e tecidos, evitando a proliferação de células que apresentem seu DNA danificado, agindo, dessa forma, como um “Guardião do Genoma” (9). Em resposta a diversos tipos de danos ao DNA, a proteína p53 é ativada e regula vários processos celulares como, por exemplo, a parada do ciclo celular, o reparo de DNA e apoptose (8,55). Alterações ou inativação do p53 podem culminar com o desenvolvimento de câncer. A proteína p53 mutada está presente em mais de 50% de todos os tumores humanos, sugerindo que a inativação, tanto dessa proteína, quanto do gene, realizam um papel central no fenômeno da tumorigênese (9,30).
O termo “Apoptose” foi primeiramente descrito por Kerr et al. (1972) (27), significa morte programada, fisiológica e apropriada, que também é renovação. Por definição, apoptose ou morte celular programada é um tipo de "autodestruição celular", que requer energia e síntese protéica para a sua execução (20,25,26). Embora a apoptose seja um processo fisiológico, pode-se induzi-la ou associá-la, também, a processos patológicos (10,52). Os mecanismos genéticos reguladores da apoptose ainda não são completamente conhecidos, porém os mediadores mais estudados são os membros da família Bcl-2, que podem ser divididos em duas subfamílias: pró-apoptótica (ex: Bax, Bcl-XS, Bad) e anti-apoptótica (ex: Bcl-2, Bcl-XL, Bcl-W). Acredita-se que o equilíbrio entre os membros pró e anti-apoptóticos seja importante na determinação do destino da célula (17,45). Proteínas anti-apoptóticas, como Bcl-2, previnem a liberação do citocromo c que se associa a outras moléculas no citoplasma e formam o apoptossomo (29,38).
A proteína Ki-67 é um antígeno nuclear expresso em todas as fases ativas do ciclo celular, mas ausente em células quiescentes. Sua presença, portanto, indica o estágio proliferativo da célula estudada (15,44).
Assim o objetivo do trabalho foi investigar a imunolocalização das proteínas que influenciam os fenômenos de controle do ciclo celular, a proteína do gene supressor de tumor TP53, sobre o fenômeno de morte celular por apoptose, pelo antígeno Bcl-2 e do crescimento celular, o antígeno Ki-67 no Carcinoma Nasofaríngeo e buscar associação entre os dados encontrados com fatores epidemiológicos, clínicos, morfológicos e de sobrevida.
Materiais e métodos
Pacientes
A presente investigação trata-se de um estudo retrospectivo, composta por quatorze pacientes diagnosticados com Carcinoma Nasofaríngeo (CN), do período de 01/01/2000 a 31/12/2010 dos serviços de oncologia dos dois hospitais de referência para o tratamento do câncer no município de Montes Claros (Santa Casa e São Lucas). Pacientes que não tinham confirmação histológica e/ou tinham neoplasias simultâneas não foram incluídos no trabalho. As informações coletadas foram: Data do diagnóstico; Idade do paciente; Sexo; Cor da pele; Consumo de álcool e tabaco; Histórico de exposição crônica ao sol; Histórico de câncer na família; Tamanho da lesão primária; Estadiamento clínico da doença (Estadiamento TNM); Presença de metástase; Tipo histológico do CN indicado pelo exame hispopatológico (I, II ou III); Data do último atendimento recebido; Recidivas locais, regionais e a distância. O tempo de sobrevida foi considerado a partir do diagnóstico até o óbito ou a data de 31/12/2010 em contato direto com os pacientes. O trabalho foi submetido à apreciação por parte do Comitê de Ética da Universidade Estadual de Montes Claros, sendo aprovado no Processo Nº 2258.
Estudo morfológico
As amostras foram classificadas por um único pesquisador de acordo com a Organização Mundial de Saúde (1997) (3), onde existem três subtipos histológicos com base no grau de diferenciação e produção de queratina: Tipo I – Carcinoma de Células Escamosas; Tipo II – Carcinoma Não-Queratinizado; Tipo III – Carcinoma Indiferenciado e também em carcinoma de células basaloides, cujo comportamento é agressivo e o prognóstico ruim (49).
Reações de imunoistoquímica
O trabalho envolveu a análise de 14 amostras primárias da lesão fixadas em formalina tamponada e emblocadas em parafina. Todas as lesões são de arquivo e, portanto, não haverá a necessidade de submeter os pacientes para a realização de procedimentos cirúrgicos/invasivos adicionais.
O material foi submetido à realização de cortes microscópicos 3 a 5 mm num micrótomo semi-automático e estendidos sobre lâminas de vidro previamente tratadas com a substância adesiva 3-aminopropiltrietoxisilano (SIGMA). As reações de imunoistoquímica foram realizadas conforme descritas no trabalho de Fraga et al. (2011) (14), modificado apenas o tampão de recuperação para o Trilogy, Cell Marker®. Os anticorpos primários utilizados foram: anti-p53 (clone DO-7, Dako, Dinamarca), anti-Bcl-2 (clone 124, Dako, Dinamarca) e anti-Ki-67 (clone MIB-1, Dako, Dinamarca). Controles positivos (tecido com padrão de reação conhecido) e negativos (o mesmo tecido em exame sem o anticorpo primário ou secundário) foram devidamente empregados.
Contagem
Foram tiradas fotos de 10 campos de cada lâmina no aumento de 400x e a contagem foi feita por um único pesquisador com o programa ImageJ®, versão 1.44 para Windows®. A contagem foi utilizada para estudos semiquantitativo e quantitativos, com especial atenção para a região do fronte invasivo do tumor. Para quantificar a expressão imunoistoquímica, consideramos como positiva a marcação nuclear para p53 e Ki-67 e citoplasmática para Bcl-2 de qualquer espécie em células do tecido epitelial tumoral da nasofaringe (Figura 1).
Análise dos dados
Todos os dados epidemiológicos e os obtidos pelas análises histológicas e imunoistoquímicas foram digitalizados e avaliados pelo programa SPSS®, versão 18.0, para Windows®. A relação dos parâmetros clínico-biológicos com os padrões de imunolocalização das proteínas p53, Bcl-2 e Ki-67 foram realizados através do teste estatístico ANOVA, o nível de significância considerado nos testes estatísticos foi fixado em 95% (p<0,05).
Resultados
Foram identificados 39 casos de Carcinoma Nasofaríngeo na região norte de Minas Gerais, sendo que foram estudados apenas quatorze pacientes, visto que apenas estes apresentavam a lesão primária. As variáveis sócio-demográficas, fatores de riscos e clínicas da amostra do estudo estão representadas na Tabela 1.
Tabela 1. Variáveis epidemiológicas e clínicas dos pacientes com CN (n = 14).
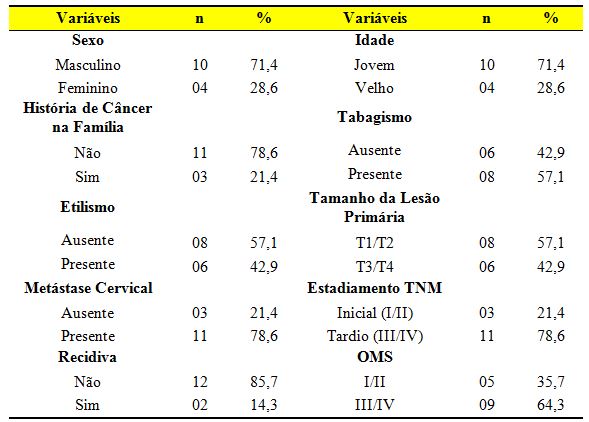
A ocorrência da doença foi verificada, principalmente, em homens adulto-jovens, sendo a média da idade de 33 anos (15-61 anos). Dentre os fatores de risco analisados, observamos uma prevalência de 57,1% do hábito tabagista e 42,9% de etilista. Com relação ao histórico de câncer na família, observamos que 78,6% dos pacientes acometidos com o carcinoma nasofaríngeo relataram ausência de neoplasia na família. Quanto aos parâmetros morfológicos das lesões de CN, observamos que a maioria dos pacientes foram diagnosticados com estadiamento clínico avançado (78,6%), enquanto 64,3% apresentavam estadiamento T3/T4. Além disso, observamos a presença de nódulos cervicais em 78,6% da amostra e recidiva em apenas dois casos.
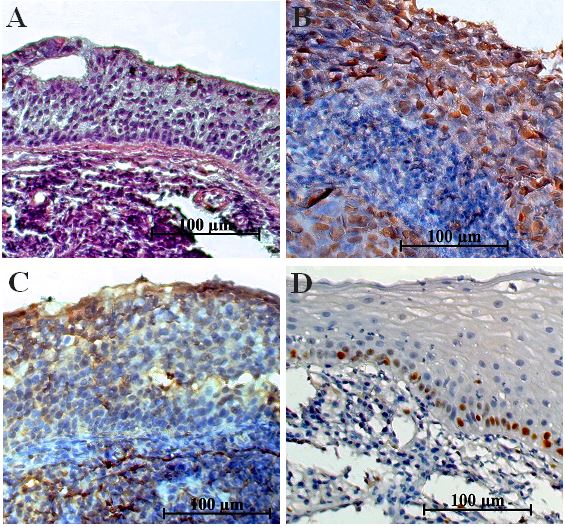
Figura 1. Imunolocalização das proteínas p53, Bcl-2 e Ki-67 no Carcinoma Nasofaríngeo. A) Controle negativo; B) Imunoexpressão
da p53; C) Imunoexpressão do Bcl-2; D) Imunoexpressão do Ki-67. (Aumento: 400X. Contracoloração: Hematoxilina de Mayer).
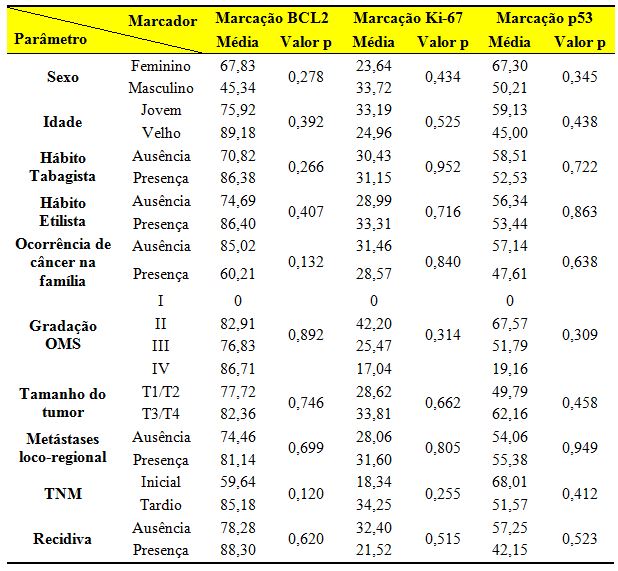
A partir da análise, não observamos uma associação estatisticamente significante em nenhuma das análises (Tabela 2).
Tabela 2. Análise da relação entre as imunolocalizações médias da p53, Bcl-2 e Ki-67 e os parâmetros clínico-biológicos
Discussão
O Carcinoma de Nasofaringe apresenta um dos piores prognósticos dentre os tumores malignos de cabeça e pescoço. Isso pode ser explicado devido ao comportamento invasivo do tumor, na dificuldade do exame nasofaríngeo e pelo fato do tumor estar localizado na proximidade da base do crânio e de outras estruturas vitais (46).
O CN é uma doença rara, correspondendo a 2% dos tumores de cabeça e pescoço e a 0,5% de todos os tumores. Entretanto, esse carcinoma representa um dos tumores malignos mais frequentes em algumas regiões endêmicas, tais como no sul da China, sudeste da Ásia, no Ártico e no norte da África (42). As prevalências dos tipos histológicos são diferentes comparando regiões endêmicas e não endêmicas. Em áreas endêmicas, o tipo III representa mais de 97% dos casos, enquanto que o tipo de I é mais comum nos países ocidentais (aproximadamente 75%) (2). Na literatura o CN do tipo I possui prognóstico pior que o II e III (24).
O CN é predominantemente encontrado nos homens entre a quarta e quinta década de vida, mantendo uma relação de 2:1 em relação às mulheres. Entretanto, tem-se observado um aumento de pacientes jovens acometidos por essa neoplasia (13). A etiologia do CN é pouco conhecida (23,37), mas dentre os fatores ambientais responsáveis por desencadear essa neoplasia destaca-se a sinusite crônica, má higiene e má ventilação dos seios nasais e uso do tabaco (16).
O CN costuma ser uma entidade clínica de curso insidioso e manifestações pouco específicas em estágios iniciais, sendo difícil estabelecer o seu diagnóstico precoce. O sintoma inicial mais comum é o aparecimento de massa cervical assintomática (1), sendo que 70% dos pacientes apresentam acometimento ganglionar no momento do diagnóstico.
Estudos prévios indicam que a ativação de proto-oncogenes ou genes de transformação, como a LMP1, ras, c-myc e Bcl-2 são freqüentemente encontrados em CN (22). Além disso, foi observado alterações e/ou inibição da função de genes supressores de tumor, incluindo FHIT, p53, p16 e p15 (22,31,40).
A inativação do gene p53 por mutações tem sido relatada na maioria dos cânceres, com incidência elevada em cânceres de mama, pulmão, tireóide, esôfago e carcinoma colorretal (21). A inativação do p53 por mutações e até mesmo exclusão, no entanto, é pouco frequente em lesões primárias de CN, sendo esse processo mais freqüente em metástases (5,11,32,33,36,50). Estudos prévios encontraram um aumento da expressão da proteína p53 em casos de CN (48).
Altos níveis de proteína Bcl-2 também foram encontrados em uma variedade de tumores sólidos, incluindo adenocarcinoma da próstata, carcinoma epidermóide de pulmão e de CN (19,35,43). O aumento da expressão da proteína Bcl-2, detectada por imunoistoquímica, tem sido demonstrada em muitos casos de CN (47,51). Além da presença em CN, a expressão do Bcl-2 também é encontrada em lesões displásicas adjacente ao carcinoma, bem como em células basais do epitélio nasofaríngeo normal (41). A expressão de Bcl-2 nas células normais pode contribuir para a expressam de fatores de sobrevivência para superar a morte celular. No entanto, essa situação pode predispor a oportunidade de adquirir uma aberração genética que levará a eventos neoplásicos (41).
Recentemente, os anticorpos monoclonais que reconhecem moléculas associadas ao ciclo celular, tais como Ki-67 e PCNA têm sido utilizados para determinar as frações de crescimento em alguns tumores (4,18). Estudos prévios sugerem que a expressão do Ki-67 pode ser um importante indicador do prognóstico do CN (56). O subtipo III de CN, que está relacionado com o crescimento celular, apresentou uma marcação predominante da proteína Ki-67. Entretanto, não foi observado marcação nas células não tumorais, que eram em sua maioria não proliferativas (7). Uma publicação anterior de Masuda e colaboradores indicou que não houve correlação entre a expressão do Ki-67 e achados clínicos do CN (34).
Pode-se concluir neste estudo que a relação das proteínas p53, Bcl-2 e Ki-67 com o Carcinoma Nasofaríngeo é uma importante fonte de investigação, entretanto, que um número de amostra mais elevado se faz necessário para uma melhor compreensão desta associação. O trabalho não avaliou a presença e atuação do Vírus Epstein-Barr (EBV) no CN, mas dentre os fatores de risco o EBV se destaca, pois tem sido apontado como o fator mais fortemente associado ao desenvolvimento do CN (2,12,23,37,39,53). Assim, uma análise da associação da presença do EBV com a expressão das proteínas p53, Bcl-2 e Ki-67 no CN pode ser o alvo de uma importante investigação.
Agradecimentos
Este estudo foi financiado pela Fundação de Amparo à Pesquisa do Estado de Minas Gerais (Fapemig) e Laboratório de Pesquisa em Saúde do Hospital Universitário Clemente de Faria da Universidade Estadual de Montes Claros - UNIMONTES.
Referências
-
Baker, S.R. Nasopharyngeal carcinoma: clinical course and results of therapy. Head Neck Surg. 3 (1980) 8-14.
-
Breda, E.; Catarino, R.J.; Azevedo, I.; Lobao, M.; Monteiro, E.; Medeiros, R. Epstein-Barr virus detection in nasopharyngeal carcinoma: implications in a low-risk area. Braz. J. Otorhinolaryngol. 76 (2010) 310-315.
-
Broders, A.C. Squamous-cell epithelioma of the skin: a study of 256 cases. Ann. Surg. 73 (1921) 141-160.
-
Brown, D.C.; Gatter, K.C. Monoclonal antibody Ki-67: its use in histopathology. Histopathology 17 (1990) 489-503.
-
Chakrani, F.; Armand, J.P.; Lenoir, G.; Ju, L.Y.; Liang, J.P.; May, E.; May, P. Mutations clustered in exon 5 of the p53 gene in primary nasopharyngeal carcinomas from southeastern Asia. Int. J. Cancer 61 (1995) 316-320.
-
Chan, A.T.; Teo, P.M.; Huang, D.P. Pathogenesis and treatment of nasopharyngeal carcinoma. Semin. Oncol. 31 (2004) 794-801.
-
Chan, J.Y.; Meng, C.L.; To, K.F.; Leung, S.F.; Chan, A.T.; Lee, K.K.; Johnson, P.J. Differential expression of the suppressor PML and Ki-67 identifies three subtypes of human nasopharyngeal carcinoma. Eur. J. Cancer 38 (2002) 1600-1606.
-
Coultas, L.; Strasser, A. The molecular control of DNA damage-induced cell death. Apoptosis. 5 (2000) 491-507.
-
Darnton, S.J. Demystified ... p53. Mol. Pathol. 51 (1998) 248-253.
-
Duke, R.C.; Ojcius, D.M.; Young, J.D. Cell suicide in health and disease. Sci. Am. 275 (1996) 80-87.
-
Effert, P.; McCoy, R.; Abdel-Hamid, M.; Flynn, K.; Zhang, Q.; Busson, P.; Tursz, T.; Liu, E.; Raab-Traub, N. Alterations of the p53 gene in nasopharyngeal carcinoma. J. Virol. 66 (1992) 3768-3775.
-
Fahraeus, R.; Fu, H.L.; Ernberg, I.; Finke, J.; Rowe, M.; Klein, G.; Falk, K.; Nilsson, E.; Yadav, M.; Busson, P.; . Expression of Epstein-Barr virus-encoded proteins in nasopharyngeal carcinoma. Int. J. Cancer 42 (1988) 329-338.
-
Fandi, A.; Altun, M.; Azli, N.; Armand, J.P.; Cvitkovic, E. Nasopharyngeal cancer: epidemiology, staging, and treatment. Semin. Oncol. 21 (1994) 382-397.
-
Fraga, C.A.; de Oliveira, M.V.; de Oliveira, E.S.; Barros, L.O.; Santos, F.B.; Gomez, R.S.; De-Paula, A.M.; Guimaraes, A.L. A high HIF-1alpha expression genotype is associated with poor prognosis of upper aerodigestive tract carcinoma patients. Oral Oncol. 2011)
-
Gerdes, J.; Lemke, H.; Baisch, H.; Wacker, H.H.; Schwab, U.; Stein, H. Cell cycle analysis of a cell proliferation-associated human nuclear antigen defined by the monoclonal antibody Ki-67. J. Immunol. 133 (1984) 1710-1715.
-
Geser, A.; Charnay, N.; Day, N.E.; de-The, G.; Ho, H.C. Environmental factors in the etiology of nasopharyngeal carcinoma: report on a case-control study in Hong Kong. IARC Sci. Publ. 1978) 213-229.
-
Geske, F.J.; Gerschenson, L.E. The biology of apoptosis. Hum. Pathol. 32 (2001) 1029-1038.
-
Hall, P.A.; Woods, A.L. Immunohistochemical markers of cellular proliferation: achievements, problems and prospects. Cell Tissue Kinet. 23 (1990) 505-522.
-
Harn, H.J.; Ho, L.I.; Liu, C.A.; Liu, G.C.; Lin, F.G.; Lin, J.J.; Chang, J.Y.; Lee, W.H. Down regulation of bcl-2 by p53 in nasopharyngeal carcinoma and lack of detection of its specific t(14;18) chromosomal translocation in fixed tissues. Histopathology 28 (1996) 317-323.
-
Hockenbery, D. Defining apoptosis. Am. J. Pathol. 146 (1995) 16-19.
-
Hollstein, M.; Sidransky, D.; Vogelstein, B.; Harris, C.C. p53 mutations in human cancers. Science 253 (1991) 49-53.
-
Huang, D. P. Epidemiology and aetiology. Van Hasselt, C. A. and Gibb, A. G. Nasopharyngeal carcinoma. 23-35. 1991. Hong Kong, The Chinese University Press.
-
Jeyakumar, A.; Brickman, T.M.; Jeyakumar, A.; Doerr, T. Review of nasopharyngeal carcinoma. Ear Nose Throat J. 85 (2006) 168-3, 184.
-
Kaasa, S.; Kragh-Jensen, E.; Bjordal, K.; Lund, E.; Evensen, J.F.; Vermund, H.; Monge, O.; Boehler, P. Prognostic factors in patients with nasopharyngeal carcinoma. Acta Oncol. 32 (1993) 531-536.
-
Kerr, J.F. A personal account of events leading to the definition of the apoptosis concept. Results Probl. Cell Differ. 23 (1999) 1-10.
-
Kerr, J.F. History of the events leading to the formulation of the apoptosis concept. Toxicology 181-182 (2002) 471-474.
-
Kerr, J.F.; Searle, J. A suggested explanation for the paradoxically slow growth rate of basal-cell carcinomas that contain numerous mitotic figures. J. Pathol. 107 (1972) 41-44.
-
Klein, G. Nasopharyngeal carcinoma (NPC) is an enigmatic tumor. Semin. Cancer Biol. 12 (2002) 415-418.
-
Kroemer, G.; Dallaporta, B.; Resche-Rigon, M. The mitochondrial death/life regulator in apoptosis and necrosis. Annu. Rev. Physiol 60 (1998) 619-642.
-
Levine, A.J. The p53 tumor-suppressor gene. N. Engl. J. Med. 326 (1992) 1350-1352.
-
Liebowitz, D. Nasopharyngeal carcinoma: the Epstein-Barr virus association. Semin. Oncol. 21 (1994) 376-381.
-
Lo, K.W.; Mok, C.H.; Huang, D.P.; Liu, Y.X.; Choi, P.H.; Lee, J.C.; Tsao, S.W. p53 mutation in human nasopharyngeal carcinomas. Anticancer Res. 12 (1992) 1957-1963.
-
Lung, M.L.; Hu, Y.; Cheng, Y.; Li, M.F.; Tang, C.M.; SK, O.; Iggo, R.D. p53 inactivating mutations in Chinese nasopharyngeal carcinomas. Cancer Lett. 133 (1998) 89-94.
-
Masuda, M.; Shinokuma, A.; Hirakawa, N.; Nakashima, T.; Komiyama, S. Expression of bcl-2-, p53, and Ki-67 and outcome of patients with primary nasopharyngeal carcinomas following DNA-damaging treatment. Head Neck 20 (1998) 640-644.
-
McDonnell, T.J.; Troncoso, P.; Brisbay, S.M.; Logothetis, C.; Chung, L.W.; Hsieh, J.T.; Tu, S.M.; Campbell, M.L. Expression of the protooncogene bcl-2 in the prostate and its association with emergence of androgen-independent prostate cancer. Cancer Res. 52 (1992) 6940-6944.
-
Nasrin, N.; Taiba, K.; Hannan, N.; Hannan, M.; al-Sedairy, S. A molecular study of EBV DNA and p53 mutations in nasopharyngeal carcinoma of Saudi Arab patients. Cancer Lett. 82 (1994) 189-198.
-
Ng, M.H.; Chan, K.H.; Ng, S.P.; Zong, Y.S. Epstein-Barr virus serology in early detection and screening of nasopharyngeal carcinoma. Ai. Zheng. 25 (2006) 250-256.
-
Nicholson, D.W.; Thornberry, N.A. Apoptosis. Life and death decisions. Science 299 (2003) 214-215.
-
Niedobitek, G. Epstein-Barr virus infection in the pathogenesis of nasopharyngeal carcinoma. Mol. Pathol. 53 (2000) 248-254.
-
Niedobitek, G.; Agathanggelou, A.; Nicholls, J.M. Epstein-Barr virus infection and the pathogenesis of nasopharyngeal carcinoma: viral gene expression, tumour cell phenotype, and the role of the lymphoid stroma. Semin. Cancer Biol. 7 (1996) 165-174.
-
Niemhom, S.; Kitazawa, S.; Murao, S.; Kunachak, S.; Maeda, S. Co-expression of p53 and bcl-2 may correlate to the presence of epstein-barr virus genome and the expression of proliferating cell nuclear antigen in nasopharyngeal carcinoma. Cancer Lett. 160 (2000) 199-208.
-
Parkin, D.M.; Bray, F.; Ferlay, J.; Pisani, P. Global cancer statistics, 2002. CA Cancer J. Clin. 55 (2005) 74-108.
-
Pezzella, F.; Turley, H.; Kuzu, I.; Tungekar, M.F.; Dunnill, M.S.; Pierce, C.B.; Harris, A.; Gatter, K.C.; Mason, D.Y. bcl-2 protein in non-small-cell lung carcinoma. N. Engl. J. Med. 329 (1993) 690-694.
-
Sawhney, N.; Hall, P.A. Ki67--structure, function, and new antibodies. J. Pathol. 168 (1992) 161-162.
-
Schultz, D.R.; Harrington, W.J., Jr. Apoptosis: programmed cell death at a molecular level. Semin. Arthritis Rheum. 32 (2003) 345-369.
-
Sham, J.S.; Choy, D. Prognostic value of paranasopharyngeal extension of nasopharyngeal carcinoma on local control and short-term survival. Head Neck 13 (1991) 298-310.
-
Sheu, L.F.; Chen, A.; Meng, C.L.; Ho, K.C.; Lin, F.G.; Lee, W.H. Analysis of bcl-2 expression in normal, inflamed, dysplastic nasopharyngeal epithelia, and nasopharyngeal carcinoma: association with p53 expression. Hum. Pathol. 28 (1997) 556-562.
-
Sheu, L.F.; Chen, A.; Tseng, H.H.; Leu, F.J.; Lin, J.K.; Ho, K.C.; Meng, C.L. Assessment of p53 expression in nasopharyngeal carcinoma. Hum. Pathol. 26 (1995) 380-386.
-
Souza, C. E., Maluf, F. C., and Buzaid, A. C. Carcinoma de Nasofaringe. Buzaid, A. C., Maluf, F. C., and Lima, C. M. R. Manual de Oncologia Clínica do Brasil. 8(38), 1636-1658. 2010.
-
Sun, Y.; Hegamyer, G.; Cheng, Y.J.; Hildesheim, A.; Chen, J.Y.; Chen, I.H.; Cao, Y.; Yao, K.T.; Colburn, N.H. An infrequent point mutation of the p53 gene in human nasopharyngeal carcinoma. Proc. Natl. Acad. Sci. U. S. A 89 (1992) 6516-6520.
-
Vera-Sempere, F.J.; Burgos, J.S.; Botella, M.S.; Morera, C. Immunohistochemical expression of Bcl-2 oncoprotein in EBV-associated nasopharyngeal carcinoma correlated to histological type and survival. Histol. Histopathol. 12 (1997) 9-18.
-
Webb, S.J.; Harrison, D.J.; Wyllie, A.H. Apoptosis: an overview of the process and its relevance in disease. Adv. Pharmacol. 41 (1997) 1-34.
-
Wei, W.I.; Sham, J.S. Nasopharyngeal carcinoma. Lancet 365 (2005) 2041-2054.
-
Yu, M.C.; Yuan, J.M. Epidemiology of nasopharyngeal carcinoma. Semin. Cancer Biol. 12 (2002) 421-429.
-
Zabkiewicz, J.; Clarke, A.R. DNA damage-induced apoptosis: insights from the mouse. Biochim. Biophys. Acta 1705 (2004) 17-25.
-
Zheng, X.; Hu, L.; Chen, F.; Christensson, B. Expression of Ki67 antigen, epidermal growth factor receptor and Epstein-Barr virus-encoded latent membrane protein (LMP1) in nasopharyngeal carcinoma. Eur. J. Cancer B Oral Oncol. 30B (1994) 290-295.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista Digital · Año 18 · N° 183 | Buenos Aires,
Agosto de 2013 |
|