
|
|||
|---|---|---|---|
|
|
Insulino resistencia, actividad física y ejercicio de sprint intervalado |
|
|
|
MSc. Entrenamiento Deportivo Diplomado en Ejercicio, Nutrición y Salud, INTA, U de Chile. Centro de Salud Familiar de Los Lagos. Centro de Promoción de la Salud de la Mujer Región de Los Ríos |
Cristian Gabriel Álvarez Lepín profecristian.alvarez@gmail.com (Chile) |
|
|
|
Resumen El objetivo de este estudio fue describir la etiología de la insulino resistencia (IR) y el ejercicio de sprint intervalado (SIT) como métodos efectivos para mejorar la salud metabólica. Se revisaron en las bases de información científica PubMed un total de 125 artículos ingresando la frase “Sprint interval Training” (SIT) y “High Intensity Interval Training” (HIIT). Fueron seleccionados estudios experimentales en humanos y revisiones de literatura. Los resultados de esta revisión literaria indican que SIT es un método de ejercicio físico eficaz para inducir insulino sensibilidad, colaborar en la fisiopatología de la insulino resistencia (IR), promover una mayor captación de glucosa e inducir una serie de señales intracelulares y moleculares en donde destacan un aumento en las proteínas kinasas AMPK y el proliferador peroxisomal PGC1-α, involucrados en el proceso de biogénesis mitocondrial, clave en la mejora del metabolismo oxidativo. Se concluye que SIT es un método de ejercicio que puede ser utilizado en la atención primaria de salud pública, pero que aún son necesarios profundizar los estudios en poblaciones patológicas como IR y DT2. Palabras clave: Insulino resistencia. Insulino sensibilidad. Actividad física. Ejercicio físico. Sprint interval training.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires - Año 17 - Nº 169 - Junio de 2012. http://www.efdeportes.com/ |
|
|
1 / 1
Insulino resistencia
La insulino resistencia (IR), es definida como un empeoramiento relativo en la habilidad de la insulina para ejercer sus efectos sobre la glucosa y metabolismo lipídico en tejidos blanco, tales como, tejido adiposo, hígado y músculo esquelético (1). Debido al desequilibrio que se produce en la homeostasis de la glucosa, las células β localizadas en el páncreas deben secretar de manera compensatoria una mayor cantidad de insulina, acción llamada hiperinsulinemia compensatoria (2), definida por valores (insulina en ayuna >60 mUI/ml) (3)
La IR es un importante factor de riesgo de diabetes mellitus tipo 2 (DM2) y de enfermedad cardiovascular (4), aunque aún no se conocen las vías exactas mediante las cuales la IR producen DT2. Debido a que el músculo esquelético es el tejido más importante para la disposición de glucosa estimulada por insulina, la IR del músculo esquelético es vista comúnmente como el componente crítico de la IR en la totalidad del cuerpo (5). La menor acción tisular de insulina sobre la regulación de la glicemia ocurre principalmente a nivel de músculo esquelético, debido a que este tejido da cuenta de más del 75% de la captación de glucosa en presencia de insulina (1)
La lucha constante de las células beta por compensar los elevados niveles de glucosa secretando más insulina, puede en algún momento fallar en esta respuesta, produciendo así hiperglicemia (glicemia en ayuno ≥100 mg/dL), generando un estado de IR periférica, progresando hacia una inadecuada secreción de insulina. Cuando las células beta del páncreas ya no son capaces de producir insulina a modo de mantener la homeostasis de la glucosa, se declara la DT2 (1, 6).
Algunos estudios han establecido defectos relacionados con la IR a nivel de: a) actividad mitocondrial, b) señales metabólicas y c) biogénesis mitocondrial, señalados como primeros responsables de IR en algunos tejidos (1, 7). La disminución de la actividad mitocondrial ha sido bien reportada y característica en sujetos con DT2 (8) e hijos de sujetos con DT2 (9-10).
Cierta evidencia encontrada en disminución de la producción de ATP mitocondrial vía insulino-estimulada en sujetos con DT2, relaciona directamente a la IR con la disminución de la actividad mitocondrial (11-12), de esta manera, se sugiere que la disfunción mitocondrial es causa importante de la IR, adquiriendo la capacidad oxidativa muscular gran capacidad para predecir insulino sensibilidad (IS) (13), aunque paralelamente también se ha sugerido que un estado de lipotóxico originado por el acúmulo de triglicéridos intra celulares irrumpiría las vías y señales involucradas con los receptores insulínicos IRS-1 (14), pues, la acumulación del contenido de triglicéridos intramusculares (TGIM) pueden afectar la función metabólica de manera independiente, siendo los lípidos también asociados a estados de IR.
La acumulación de TGIM sugiere una disminución en la oxidación de grasa en forma de ácidos grasos lo cual también afectaría la flexibilidad metabólica celular (15), definida como la habilidad de la célula para ajustar el nivel de oxidación de lípidos y carbohidratos necesarios para mantener las demandas basales de acuerdo a la disponibilidad de combustible (16-17). También la acumulación de TGIM disminuye la cascada de señales de múltiples proteínas, entre ellas la disminución de la translocación de “carriers” o transportadores de glucosa Glut-4, reduciendo así la captación de glucosa (18).
Se ha reportado que tanto la disfunción mitocondrial en términos de densidad, la lipotoxicidad, los receptores insulínicos, los transportadores Glut-4 y la flexibilidad metabólica son mejorados con actividad física (16, 19-21). Si bien es cierto que el envejecimiento trae consigo una disminución en la tolerancia a la glucosa (22), también existe evidencia de que el estatus de estilo de vida (dieta, tabaco, consumo de alcohol, genética) donde también se incluyen los niveles de actividad física, juegan un rol importante para su desarrollo. El incrementar de las vías de señal de la actividad enzimática se encuentra bien reportado, pues sujetos en actividad física regular vs. sujetos con IR, presentan amplias diferencias.
Recientemente se han reportado algunos métodos de actividad física que aumentarían la insulino sensibilidad por diferentes mecanismos fisiológicos (21, 23-24), y mejorarían así estados de IR, alteración clave en el posterior desarrollo de DT2, enfermedad renal, ocular, responsable de progresivas amputaciones para las personas que la sufren y también importante responsable de los elevados costos invertidos en arsenal farmacológico en algunas naciones (25), así como en los enormes gastos en tratamientos con personal humano e insumos de salud.
Métodos para la valoración de IR
Usualmente el clamp euglicémico hiperinsulinémico se ha descrito a través de la literatura como el gold standard entre los métodos de laboratorio en vivo existentes, y con este método se puede medir la cantidad de glucosa metabolizada por los tejidos periféricos mediante estimulación con insulina (26).
El modelo de determinación de la homeostasis (HOMA-IR) (27) estima la IR y función de las células β mediante las concentraciones en ayunas de glucosa e insulina y ha demostrado ser un buen equivalente frente a pruebas como el clamp euglicémico-hiperinsulinémico, con una correlación de r = 0.88 (26-27).
Otras pruebas como la prueba de tolerancia oral a la glucosa, consistente en la ingestión de 75 g de glucosa vía oral y la extracción de una muestra sanguínea posterior a 2 horas de esta carga, indica valores de intolerancia a la glucosa demandando una escaza capacidad de los tejidos para metabolizar este sustrato de acuerdo a (Gl >140 mg/dl).
En Chile, un estudio en 120 individuos aparentemente sanos entre 19 y 40 años, encontró que los valores de HOMA-IR fluctuaron entre 0.5 y 3.0, definiendo un punto de corte para RI basándose en el promedio más una desviación estándar, esto es, HOMA: 2.53 (26).
Algunos autores han clasificado los métodos para la valoración de la IR basados en diferentes aspectos (28):
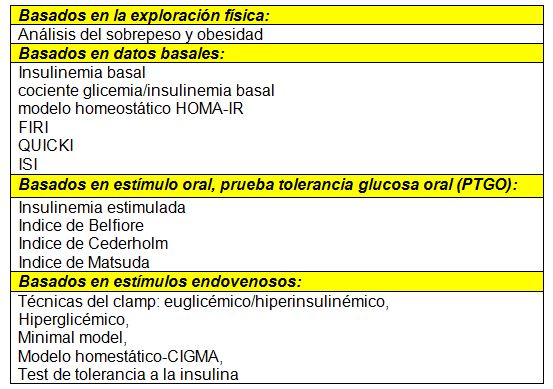
Actividad física
La actividad física es caracterizada por un amplio rango de movimientos del músculo esquelético, que resultan en un determinado gasto energético. El ejercicio es definido como un movimiento planificado, estructurado y de actividad física repetitiva con el propósito de mejorar uno o más componentes del fitness físico (29).
La práctica de ejercicio físico se ha asociado con la mejora de una serie de factores de riesgo cardiovascular y alteraciones cardio-metabólicas, considerados como “modificables” como son: aumento del colesterol total (CT) y lípidos de baja densidad (LDL), disminución de HDL, cigarrillo, hipertensión, diabetes, obesidad, estrés, y sedentarismo (30).
En muchas comparaciones entre ejercicio, intervención nutricional y farmacológica, el ejercicio físico es reportado como un método mucho más eficiente para mejorar alteraciones metabólicas como la disminución en la insulino sensibilidad (IS), clave en IR y DT2 (3, 31). Por un lado, el ejercicio físico actúa de manera sistémica, es decir en varios sistemas y órganos (aparato cardiorrespiratorio, sistema circulatorio, inmune, músculo esquelético y tejido adiposo), además de sus comprobados beneficios sobre aspectos emocionales (32-33), el estado de ansiedad (34), imagen corporal (35) y la liberación de hormonas endorfinas (36-37), produce que además los sujetos sometidos a ejercicio físico, usualmente tengan la posibilidad de modificar su estilo de vida (38).
La intervención nutricional por su parte, tiene accionar principalmente en base a la restricción de ingesta energética, existiendo abundante evidencia en los efectos sobre la disminución del peso corporal (39), aunque lamentablemente parte de esta pérdida de masa corporal es grasa y otra parte puede ser también masa muscular, maquinaria metabólica fundamental para el control metabólico (40). Aún así con objetivo de mejorar la salud metabólica ambas intervenciones (ejercicio y dieta), son metodologías mucho más poderosas actuando ambas paralelamente en relación a la aplicación de sólo una de estas (41).
En el tratamiento farmacológico como en estados de IR, síndrome metabólico y DT2, es abordado en primera instancia principalmente con fármacos como la “Metformina”, que tienen acción únicamente local, es decir, actúan sólo a nivel de algunos órganos como el páncreas, hígado y escasamente a nivel muscular, imitando la acción del ejercicio sobre proteínas kinasas claves en la regulación del metabolismo de lípidos y carbohidratos como la proteína kinasa AMPK (42), la cual además tiene acciones claves en el mARN produciendo una cascada de eventos que aumentan otros factores como PGC1-α, marcador conocido por su relevancia en la biogenesis mitocondrial (43-44). La Metformina tiene efectos en la producción hepática de glucosa, estimula una mayor utilización de la glucosa periférica mediada por insulina, aumenta la actividad de los transportadores de glucosa Glut-4, así como de la enzima glucógeno sintetasa y hoy en día también al proliferador peroxisomal PGC1-α relacionado con el proceso de biogenesis mitocondrial en ratas, respectivamente (45-46).
El fitness cardiorrespiratorio es altamente asociado con una disminución de factores de riesgo (47) y es predictor independiente de mortalidad en adultos (48). Un estudio reporto una disminución de un 41% en la prevalencia de desarrollo de síndrome metabólico posterior a la intervención de 3 años, donde se incluyó cambio del estilo de vida y actividad física (3, 41). La captación de glucosa y ácidos grasos es aumentada en sujetos con DT2 cuando estos participan de programas de actividad física como en el ejercicio de fuerza y de intervalos de alta intensidad (49-50).
Algunos aspectos moleculares de la actividad física y ejercicio
Cuando se han comparado sujetos control vs pares sometidos a dieta hipocalórica baja en grasa y participaban en 150 minutos de actividad física/semana, se disminuyo un 58% la prevalencia a DT2 (3). Son varias las vías intracelulares activadas que finalizan en una mejora de la insulino sensibilidad a través del ejercicio, entre ellas una mejora en la utilización y captación de glucosa en todo el cuerpo, atribuible al aumento de transportadores Glut-4 (19-20), los cuales aumentan la expresión de proteínas en mARN (19), el contenido (20) asociándose esto con una mejora en la captación de glucosa.
La importancia de esta mayor captación de glucosa es vital para la construcción y almacenamiento de glucógeno muscular y hepático, forma de energía importante para acciones que demandan alta intensidad de ejercicio y generar supercompensación (51). El aumento de Glut-4, son igualmente asociados con el aumento en la señalización para la insulina, incrementándose así la disposición de los receptores insulínicos IRS-1 y IRS-2, ambos asociados a la actividad de fosfatidil-inositol-3-kinasa PI3K durante actividad física con ejercicio (1).
El incremento en el contenido y actividad de proteínas, consecuente del aumento en las vías de señalización a esta hormona, paralelamente también son responsables de una serie de cascada de otras señales de proteínas como Akt, Akt substrato AS160 (52).
Una proteína importante para inducir mejoras en el metabolismo de carbohidratos y lípidos mediante ejercicio, es la proteína kinasa activada AMPK, la cual se ha podido reportar que es activada en sujetos diabéticos similar a sujetos sanos (53), situación que abrió la posibilidad a que sujetos con DT2 y con alteración a la señalización y cascada de insulina puedan activar AMPK por una vía independiente a la insulina. El aumento en AMPK es relacionado con un imbalance en la relación AMP/ATP (54), el aumento del calcio sarcoplasmático (55), el contenido de glicógeno previo a ejercicio (54).
Son varios los estudios relacionado con actividad física utilizando ejercicio endurance que han logrado mejorar la IR y aumentar la insulino sensibilidad (16, 56), de manera que la actividad física a través de diferentes métodos de ejercicio es reconocida por ser una terapia alternativa, aunque aún así escasamente considerada con fines de prevención y terapia.
Sprint interval training
El entrenamiento de intervalos ha sido utilizado desde ya muchos años atrás por atletas para mejorar el poder de la performance. El entrenamiento de Sprint intervalado fue introducido hace 70 años atrás por Woldemar Gerchler para mejorar las acciones atléticas explosivas (57). Este método de ejercicio consiste en realizar breves y repetidas series de ejercicio a una alta intensidad, pudiendo ocasionar cambios metabólicos en el músculo esquelético humano y que pueden jugar un rol clave en la mejora de alteraciones cardio-metabólicas modernas (58-61).
Investigadores de la Universidad de Melbourne, Australia como Mark Heargreaves (40) y otros de La Universidad de McMaster, Canadá a través de los investigadores Martin Gibala y Kirsten Burgomaster entre otros, han jugado un rol clave en mostrar evidencia desde el punto de vista de la biología molecular del ejercicio (23, 43, 62-64) en lo que hasta hace 40 años atrás la literatura argumentaba que prácticamente metodologías como los sprint intervalados de alta intensidad tenían pocos y nulos cambios en la actividad enzimática mitocondrial (65-66).
También se ha podido establecer que SIT podría ofrecer similares adaptaciones en relación al ejercicio tradicional endurance, mejorando la oxidación de carbohidratos, oxidación de lípidos y la capacidad metabólica del músculo esquelético, observados en sujetos sometidos a SIT durante un rango de dos o más semanas (6 sesiones SIT) (20, 60, 63, 67).
Ante tal evidencia de similitud entre los efectos del ejercicio tradicional endurance y SIT, considerando las enormes diferencias en el volumen total de tiempo invertido en ejercicio endurance (≥ 30 min/sesión) vs. SIT (≤15 min/sesión) y recordando la excusa máster de la población para la no práctica de actividad física y ejercicio como lo es la falta de tiempo, evidenciada desde hace 20 años atrás (68) hasta los actuales tiempos, la práctica de metodologías como SIT podrían acercar un poco más al ejercicio a la población, adquiriendo también esta metodología el carácter de estrategia tiempo-eficiente tanto para mejorar la salud metabólica como para la promoción de la salud (24, 69).
Sprint interval training vs ejercicio endurance
Dentro de las variables utilizadas para cuantificar la carga del ejercicio (intensidad, volumen, frecuencia y densidad), usualmente las primeras juegan un rol importante en las adaptaciones fenotípicas (70), jugando en SIT la intensidad un rol fundamental para estimular a AMPK. SIT es caracterizado por la realización de varias repeticiones (usualmente 20 a 30 segundos) de sprint con elevada carga (watts) muscular similar al Wingate test, acumulando un tiempo total de ejercicio en volumen total/sesión (≤ 15 minutos), considerado así como una metodología tiempo-efectiva para producir cambios metabólicos en el músculo esqueléticos, los cuales conllevan a una mejora en la sensibilidad a la insulina.
Se han encontrado aumentos en las enzimas glicolíticas y oxidativas posterior a la práctica de 2 a 7 semanas de SIT, donde respecto al inicio de cada programa la enzima hexokinasa HK aumentó un 56% y la fosfofructokinasa un 49%. Paralelamente en estos estudios, también aumentaron significativamente las enzimas relacionadas con el metabolismo oxidativo como citrato cintetasa y succinato deshidrogenasa en un 36% y 29% respectivamente, así como la maleato deshidrogenasa en un 65% (71).
En dos semanas de SIT también se han encontrado un aumento significativo de beta-hidroxiacil-CoA deshidrogenasa (β-HAD), enzima relacionada con el metabolismo oxidativo de ácidos grasos (72). Por otro lado también se ha reportado que 6 sesiones de SIT durante dos semanas de ejercicio, producen un incremento en el almacenamiento de glucógeno en un 26% así como un incremento en la actividad de la enzima citrato sintetasa en 38% (62).
En base a los incrementos encontrados a nivel del contenido y actividad de enzimas aeróbicas, se han encontrado nuevos marcadores del proceso de biogénesis mitocondrial, lo cuales serían respondedores agudos posterior a pocas sesiones de SIT como lo son las enzimas citocromo c oxidasa subunidad IV (COXIV), la cual se manifiesta incrementada en un 35% respecto al inicio (63). Similares incrementos a una sesión de SIT se ha encontrado en PGC1-α, proliferador peroxisomal de rol primordial en el proceso de biogénesis mitocondrial (20).
Por otro lado respecto a la performance, el ejercicio endurance ha sido el método de ejercicio por excelencia para mejorar el fitness cardiorespiratorio y al parecer SIT también parece ofrecer mejoras importantes a nivel del consumo de oxígeno (VO2máx) (20, 62, 64, 71), incluso mejorando la capacidad buffer, de amortiguación de desechos metabólicos generados por el lactato, incrementando mayormente los transportadores monocarboxilados I y IV encargados de la reconversión de lactato-piruvato (73-74).
La capacidad de trabajo muscular también ha sido demostrada incrementada posterior a 6 sesiones de SIT, incrementándose el trabajo muscular en pruebas de 50 Kj en 9.8% su carga en (watts) y en pruebas de 750 Kj un aumento de 10.5% de watts (20). En este mismo estudio los Glut-4, aumentaron un 119% posterior a 6 sesiones de SIT, adquiriendo esta metodología una importante relevancia para sujetos con IR, hiperglicemia y DT2.
Se ha reportado que SIT mejora la capacidad aeróbica de manera similar al ejercicio tradicional de endurance, caracterizado este último por un lago volumen de duración en relación al primero, pudiendo ocurrir algunas de estas adaptaciones de SIT en sólo un 10% del tiempo total que se ocuparía mediante ejercicio endurance (23)
En suma, la anterior evidencia muestra que una o más sesiones de SIT durante cortos períodos de ejercicio pueden producir un estrés muscular importante capaz de generar la estimulación de AMPK.
Alteraciones cardio-metabólicas de salud pública
Actualmente la situación de carga económica para los sistemas de salud pública se ha tornado muy complicada desde el punto de vista de los costos y financiamiento. Gran parte de esta responsabilidad la demandan los programas de salud cardiovascular y aquellos programas que sustentan la atención de los millones de sujetos con enfermedades modernas como las alteraciones insulino resistencia y DT2, que usualmente también se relacionan con estados de sobrepeso, obesidad, hipertensión o síndrome metabólico. La literatura es contundente respecto a que la principal base de estas enfermedades y alteraciones metabólicas reside en la inactividad física. El costo económico que generan las enfermedades modernas ha sido publicado por varias naciones (75), así como los costos generados por la situación de inactividad física (76).
En Chile la Encuesta Nacional de Salud del periodo 2009-2010, ha aportado pruebas de que más del 10% de las mujeres en Chile son diabéticas y más del 38% sufren de hipercolesterolemia (CT>200 mg/dl) (77), alteración en el perfil lipídico, que es usualmente relacionada con dislipidemia (LDL >140 y HDL <30 mg/dl), obesidad (IMC> 30 kg/m2) y otros factores (inactividad física, sedentarismo, genética, alimentación) que pueden aumentar el riesgo de enfermedad cardiovascular (ECV) (78). En los últimos años, la mortalidad asociada con DT2 se ha incrementado un 20% (79) y las complicaciones asociadas, como la nefropatía diabética, había aumentado 78% desde 2000 hasta 2008 (80).
Es importante continuar ampliando las investigaciones y reportes de metodologías de actividad física como el ejercicio físico de SIT, pues junto con mejorar las ya evidenciadas mejoras en alteraciones metabólicas como la IR y DT2, también la inclusión programas y profesionales de las ciencias del ejercicio en la Atención Primaria de Salud pública puedan apaliar el algún grado en continuo avance de las enfermedades modernas producidas por la inactividad física.
No es un sueño en la Atención Primaria de Salud pública ofrecer la pregunta a los usuarios de este sistema: ¿Cómo desea ser compensado? ¿Con fármacos o ejercicio físico?
Referencias
-
Abdul-Ghani MA, y DeFronzo, R.A. Pathogenesis of Insulin Resistance in Skeletal Muscle. Journal of Biomedicine and Biotechnology. 2010:1-19.
-
Erdmann J, Kallabis, B., Oppel, U., Sypchenko, O., Wagenpfeil, S. and Schusdziarra, V. Development of hyperinsulinemia and insulin resistance during the early stage of weight gain. American Journal of Physiology. 2008;294(3):E568-E75.
-
Group Diabetes Prevention Program Research. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. The New England Journal of Medicine. 2002;346(6):393-403.
-
DeFronzo RA. Pathogenesis of type 2 diabetes: metabolic and molecular implications for identifying diabetes genes. Diabetes Reviews. 1997;5(3):pp 177-269.
-
Turcotte LP, Fisher JS. Skeletal Muscle Insulin Resistance: Roles of Fatty Acid Metabolism and Exercise. Physical Therapy. 2008 November 2008;88(11):1279-96.
-
DeFornzo RA. The triumvirate: β-cell, muscle, liver. A collusion responsible for NIDDM. Diabetes. 1988;37(6):667-87.
-
Hawley JA, and Lessard, S.J. Exercise training-induces improvements in insulin action. Acta Physiol. 2008;192:127-35.
-
Turner, N, and Heilbronn, L. Is mitocondrial dysfunction a causa of insulin resistance? Trends in Endocrinology and Metabolism. 2008;19(9):324-30.
-
Befroy DE, Petersen, K.E., Dufour, S., Mason, G.F., Graaf, R.A., Rothman, D.L. and Shulman, G.I. . Impaired Mitochondral Substrate Oxidation in Muscle of Insulin Resistant Offspring of Type 2 Diabetic Patients. Diabetes. 2007;56:1376-81.
-
Perseghin G, Ghosh S, Gerow K, and, Shulman GI. Metabolic defects in lean nondiabetic offspring of NIDDM parents: a cross-sectional study. Diabetes. 1997;46(6):1001-9.
-
Abdul-Ghani MA, and DeFronzo, R.A. Mitochondrial dysfunction, insulin resistance, and type 2 diabetes mellitus. Current Diabetes Reports. 2008;8(3):173-8.
-
Stump CS, Short, K.R., Bigelow, M.L., Schimke, J.M., and Nair, K.S. Effect of insulin on human skeletal muscle mitochondrial ATP producction, protein synthesis, and mRNA transcripts. Proceedings of the National Academy of Sciences of the United States of America. 2003;100:7996-8001.
-
Bruce C, Anderson, M.J., Carey, A.L., Newman, D.G., Bonen, A., Kriketos, A.D., Cooney, G.J., and Hawley, J.A. Muscle Oxidative Capacity Is a Better Predictor of Insulin Sensitivity than Lipid Status. J Clin Endocrinol Metab. 2003;88:5444-51.
-
White M. IRS-signalling system: a network of docking proteins that mediate insulin action. Molecular and Cell Biochemistry. 1998;182:3-11.
-
Perseghin G, Scifo P, De Cobelli F, et al. Intramyocellular triglyceride content is a determinant of in vivo insulin resistance in humans: a 1H-13C nuclear magnetic resonance spectroscopy assessment in offspring of type 2 diabetic parents. Diabetes. 1999;48(8):1600-6.
-
Bruce CR, and Hawley, J.A. Improvements in insulin resistance with aerobic exercise training: a lipocentric approach. Med Sci Sport Exer. 2004;36:1196-201.
-
Goodpaster BH, and Kelley, D.E. Skeletal muscle triglyceride: marker or mediator of obesity-induced insulin resistance in type 2 diabetes mellitus? Curr Diab Rep. 2002;2:216-22.
-
Galgani JE, Moro, C., and Ravussin, E. Metabolic flexibility and insulin resistance. Am J Physiol Endocrinol Metab. 2008;295:E1009-17.
-
Kraniou, G.N., Cameron-Smith, D., Hargreaves, M. Acute exercise and GLUT4 expression in human skeletal muscle: influence of exercise intensity. Journal of Applied Physiology. 2006;101(3):934-7.
-
Little, J.P., Safdar, A., Wilkin, G.P., Tarnopolsky, M.A., Gibala, M.J. A practical model of low-volume high-intensity interval training induces mitochondrial biogenesis in human skeletal muscle: potential mechanisms. The Journal of Physiology. 2010 March 15, 2010;588(6):1011-22.
-
Goodpaster, B.H., Katsiaras, A., Kelley, D.E. Enhanced Fat Oxidation Through Physical Activity Is Associated With Improvements In Insulin Sensitivity in Obesity. Diabetes. 2003;52:2119-97.
-
DeFronzo, R.A. Glucose intolerance and aging. Evidence for tissue insensitivity to insulin. Diabetes. 19791979.;28(12):1095-101.
-
Gibala, M.J., Little, J.P., Van, Essen, M., Wilkin, G.P., Burgomaster, K.A., Safdar, A., et al. Short-term sprint interval versus traditional endurance training: similar initial adaptations in human skeletal muscle and exercise performance. The Journal of Physiology. 2006 September 15, 2006;575(3):901-11.
-
Little, J.P., Gillen, J.B., Percival, M.E., Safdar, A., Tarnopolsky, M.A., Punthakee, Z., et al. Low-volume high-intensity interval training reduces hyperglycemia and increases muscle mitochondrial capacity in patients with type 2 diabetes. Journal of Applied Physiology. 2011 December 1, 2011;111(6):1554-60.
-
ADA. American Diabetes Association: economic cost of diabetes in the US in 2007. Diabetes Care. 2008;31(3):596-615.
-
Acosta, AM, Escalona, M., Maiz , A., Pollak, F., Leighton, F. Determinación del índice de resistencia insulínica mediante HOMA en una población de la Región Metropolitana de Chile. Rev méd Chile 2002;130(11):1227-31.
-
Matthews, D.R., Hosker, J.P., Rudenski, A.S., Naylor, B.A., Treacher, D.F., Turner, R.C. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia. 1985;28(7):412-9.
-
Perez, M., y Montoya, E. Técnicas para el estudio de la resistencia insulínica. Una valoración crítica. Av Diabetol. 2001;17:179-86.
-
Carpersen, C.J., Powell, K.E., and, Christenson, G.M. Physical Activity, Exercise and Physical Fitness: Definitions and Distinctions for Health-Related Research. Public Health Reports. 1985;100:126-31.
-
Albala, C., Olivares, S., Salinas, J., y Vío, F. (Editores). Bases, prioridades y desafíos de la promocion de la salud. Santiago, Chile: Editorial Andros Impresores; 2004.
-
DeFornzo, R.A, Sherwin, R.S., and Kraemer, W.J. Effect of physical training on insulin action in obesity. Diabetes. 1987;36:1379-85.
-
Fox, K.R. The influence of physical activity on mental well-being. Public Health Nutrition. 1999;2(3a):411-8.
-
DeGeus, E.J.C. y DeMoor, M.H.M. A genetic perspective on the association between exercise and mental health. Mental Health and Physical Activity. 2008;1:53-61.
-
Asci, F.H. The effects of physical fitness training on trait anxiety and physical self-concept of female university students. Psychology of Sport and Exercise. [doi: 10.1016/S1469-0292(02)00009-2]. 2003;4(3):255-64.
-
Kirkcaldy, B.D., Shephard, R.J., Siefen, R.G. The relationship between physical activity and self-image and problem behaviour among adolescents. Social Psychiatry and Psychiatric Epidemiology. 2002;37(11):544-50.
-
Pedersen, B.K., Ullum, H. NK cell response to physical activity: possible mechanisms of action. Medicine and science in sports and exercise. 1994;26(2):140-6.
-
Farrell, P.A., Kjaer, M., Bach, F.W., Galbo, H. Beta-endorphin and adrenocorticotropin response to supramaximal treadmill exercise in trained and untrained males. Acta Physiologica Scandinavica. 1987;130(4):619-25.
-
Harris, S.B., Petrella, R.J., Leadbetter, W. Lifestyle interventions for type 2 diabetes. Relevance for clinical practice. Canadian Family Physician. 2003 December 1, 2003;49(12):1618-25.
-
Jakicic, J.M., Clark, K., Coleman, E., Donnelly, J.E., Foreyt, J., Melanson, E., et al. American College of Sports Medicine position stand. Appropriate intervention strategies for weight loss and prevention of weight regain for adults. Medicine and science in sports and exercise. 2001;33(12):2145-56.
-
Hargreaves, M., McKenna, M.J., Jenkins, D.G., Warmington, S.A., Li, J.L., Snow, R.J., et al. Muscle metabolites and performance during high-intensity, intermittent exercise. Journal of Applied Physiology. 1998 May 1, 1998;84(5):1687-91.
-
Orchard, D., Temprosa, M., Goldberg, R., Haffner, S., Ratner, R., Marcovina, S., and Fowler, S. The effect of metformin and intensity lifestyle intervention on the metabolic syndrome: the Diabetes Prevention Program randomized trial. Ann Intern Med. 2005;142:611-9.
-
Gundewar, S., Calvert, J.W., Jha S, Toedt-Pingel I, Yong Ji S, Nunez D, et al. Activation of AMP-Activated Protein Kinase by Metformin Improves Left Ventricular Function and Survival in Heart Failure. Circulation Research. 2009 February 13, 2009;104(3):403-11.
-
Gibala, M.J., McGee, S.L., Garnham, A.P., Howlett, K.F., Snow, R.J., Hargreaves, M. Brief intense interval exercise activates AMPK and p38 MAPK signaling and increases the expression of PGC-1α in human skeletal muscle. Journal of Applied Physiology. 2009 March 2009;106(3):929-34.
-
Egan, B., Carson, B.P., Garcia-Roves, P.M., Chibalin, A.V., Sarsfield, F.M., Barron, N., McCaffrey, N., Moyna, N.M., Zierath, J.R., and O’Gorman, D.J. Exercise intensity-dependent regulation of peroxisome proliferator-activated receptor γ coactivator-1α mRNA abundance is associated with differential activation of upstream signalling kinases in human skeletal muscle. J Physiol. 2010;588(10):1779-0.
-
Bikman, Bea. Metformin improves Insulin Signaling in Obese Rats vía Reduced IKKβ Action in a Fiber-Type Specífic Manner. Journal of Obesity. 2009;2010:1-8.
-
Suwa, M., Egashira, T., Nakano, H., Sasaki, H., Kumagai, S. Metformin increases the PGC-1α protein and oxidative enzyme activities possibly via AMPK phosphorylation in skeletal muscle in vivo. Journal of Applied Physiology. 2006 December 2006;101(6):1685-92.
-
O'Donovan, G., Owen, A., Bird, S.R., Kearney, E.M., Nevill, A.M., Jones, D.W., et al. Changes in cardiorespiratory fitness and coronary heart disease risk factors following 24 wk of moderate- or high-intensity exercise of equal energy cost. Journal of Applied Physiology. 2005 May 1, 2005;98(5):1619-25.
-
Sui, X., LaMonte, M.L., Laditka, J.N., Hardin, J.W., Chase, N., Hooker, S.P., Blair, S.N. Cardiorespiratory Fitness and Adiposity as Mortality Predictors in Older Adults. JAMA. 2007;298(21):2507-16.
-
Dunstan, D.W., Vulikh, E., Owen, N., Jolley, D., Shaw, J., Zimmet, P. Community Center–Based Resistance Training for the Maintenance of Glycemic Control in Adults With Type 2 Diabetes. DIABETES CARE. 2006;29(12):2586-91.
-
Jung, M.E., Little, J.P., Gillen, J., Punthakee, Z., Gibala, M.J. It's Not Too Hard! Perceived Enjoyment for High-intensity Interval Training in Type 2 Diabetes: 596: Board #6 3:15 PM - 5:15 PM. Medicine & Science in Sports & Exercise. 2011;43(5):20 10.1249/01.MSS.0000402728.18160.9e.
-
Greiwe, J.S., Hickner, R.C., Hansen, P.A., Racette, S.B., Chen, M.M., and Holloszy, J.O. Effects of endurance exercise training on muscle glycogen accumulation in humans. J Appl Physiol. 1999;87:222-6.
-
Frosig, C., Jorgensen, S.B., Hardie, D.G., Richter, E.A., and Wojtaszewsky, J.F.P. Effects of Endurance Exercise Training on Insulin Signaling in Human Skeletal Muscle:Interactions at the Level of Phosphatidylinositol 3-Kinase, Akt, and AS160. Diabetes. 2007;56:2093-102.
-
Musi, N., and Fuji, N. AMPK is actived in muscle of sujject with type 2 diabetes during exercise. Diabetes. 2001;50:921-7.
-
McBride, and Hardie, D.G. AMP-activated protein kinase – a sensor of glycogen as well as AMP and ATP? Acta Physiol. 2009;196:99-113.
-
Richter, E., and Ruderman, N. AMPK and the biochemistry of exercise: implications for human health and disease. Biochemistry Journal. 2009;418:261-75.
-
Houmard, J.A., Tanner, C.J., Slentz, C.A., Duscha, B.D., McCartney, J.S., Kraus, W.E. Effect of the volume and intensity of exercise training on insulin sensitivity. Journal of Applied Physiology. 2004 January 1, 2004;96(1):101-6.
-
Coyle, E.F. Very intense exercise-training is extremely potent and time efficient: a reminder. J Appl Physiol. 2005;98:1983-4.
-
Babraj, J.A., Vollaard, N.B.J., Keast, C., Guppy, F.M., Cottrell, G. and Timmons, J.A. Extremely short duration high intensity interval training substantially improves insulin action in young healthy males. BMC Endocrine Disorders. 2009;9(3):1-8.
-
Astorino, T.A., Allen, R.P., Jurancich, M., Roberson, D.W., Lewis, R. Adaptations to High Intensity Training are Independent of Gender: 1338: Board #74 June 1 11:00 AM - 12:30 PM. Medicine & Science in Sports & Exercise. 2011;43(5):269 10.1249/01.MSS.0000400738.22764.0c.
-
Burgomaster, K.A., Heigenhauser, G.J.F., Gibala, M.J. Effect of short-term sprint interval training on human skeletal muscle carbohydrate metabolism during exercise and time-trial performance. Journal of Applied Physiology. 2006 June 1, 2006;100(6):2041-7.
-
Harmer, A.R., Chisholm, D.J., Mackenna, M.J., Hunter, S.K., Ruell, P.A., Naylor, J.M., Maxwell, L.J., and Flack, J.R. Sprint Training Increases Muscle Oxidative Metabolism During High-Intensity Exercise in Patients With Type 1 Diabetes. Diabetes Care. 2008;31(11):2097-102.
-
Burgomaster, K.A., Hughes, S.C., Heigenhauser, G.J.F., Bradwell, S.N., Gibala, M.J. Six sessions of sprint interval training increases muscle oxidative potential and cycle endurance capacity in humans. Journal of Applied Physiology. 2005 June 1, 2005;98(6):1985-90.
-
Burgomaster, K.A., Cermak, N.M., Phillips, S.M., Benton, C.R., Bonen, A., Gibala, M.J. Divergent response of metabolite transport proteins in human skeletal muscle after sprint interval training and detraining. American Journal of Physiology - Regulatory, Integrative and Comparative Physiology. 2007 May 2007;292(5):R1970-R6.
-
Burgomaster, K.A., Howarth, K.R., Phillips, S.M., Rakobowchuk, M., MacDonald, M.J., McGee, S.L., et al. Similar metabolic adaptations during exercise after low volume sprint interval and traditional endurance training in humans. The Journal of Physiology. 2008 January 1, 2008;586(1):151-60.
-
Henriksson, JR., J.S. Quantitative measures of enzyme activities in tipe I and Tipe 2 muscle fibres of man after training Acta Physiologica Scandinavica 1976;97:392-7.
-
Hickson, R.C., Heusner, W.W., and Van Huss, W.D. Skeletal muscle enzyme alterations after sprint and endurance training. J Appl Physiol. 1976;40:868-71.
-
Whyte, L.J., Gill, M.R., Cathcart, A.J. Effect of 2 weeks of sprint interval training on health-related outcomes in sedentary overweight/obese men. Metabolism Clinical and Experimental. 2010;59:1421-8.
-
Skarfors, E.T., Wegener, T.A., Lithell, H., and Selinus, I. Physical training as treatment for type 2 (non-insulin-dependent) diabetes in elderly men. A feasibility study over 2 years. Diabetologia. 1987;30:930-3.
-
Gibala, M.J., McGee, S.L., Garnham, A.P., Howlett, K.F., Snow, R.J., and Hargreaves, M. High-intensity Interval Training: A Time-efficient Strategy for Health Promotion? Ontario, Canada: Current Sports Medicine Reports; 2007. p. 211-3.
-
García Manso, J.M., Navarro, M., y Ruiz, J.A., (Editores). Bases Teóricas del entrenamiento deportivo. Mdrid, España.1996.
-
MacDougall, J.D., Hicks, A.L., MacDonald, J.R., McKelvie, R.S., Green, H.J., Smith, K.M. Muscle performance and enzymatic adaptations to sprint interval training. Journal of Applied Physiology. 1998 June 1, 1998;84(6):2138-42.
-
Rodas, G., Ventura, J.L., Cadefau, J.A., Cussó, R., and Parra, J. A short training programme for the rapid improvement of both aerobic and anaerobic metabolism. European Journal of Applied Physiology. 2000;82:480-6.
-
Bishop, D., Edge, J., Thomas, C., Mercier, J. High-intensity exercise acutely decreases the membrane content of MCT1 and MCT4 and buffer capacity in human skeletal muscle. Journal of Applied Physiology. 2007 February 2007;102(2):616-21.
-
Edge, J., Bishop, D., Goodman, C., and Dawson, B. Effects of High- and Moderate-Intensity Training on Metabolism and Repeated Sprints. Medicine & science in sports & exercise. 2005:1975-82.
-
ADA. American Diabetes Assossiation. Economic Costs of Diabetes in the U.S. in 2007. Diabetes Care. 2008 March 2008;31(3):596-615.
-
Cisternas C. El costo económico que genera la inactividad física. Santiago, Chile: Universidad de Chile; 2002.
-
Minsal. Ministerio de Salud, Gobierno de Chile. Segunda Encuesta Nacional de Salud 2009-2010. 2010, 12 marzo 2012.
-
Sayeed, M.A., Mahtab, H., Latif, Z.A. Waist-to-height ratio is a better obesity index than body mass index and waist-to-hip ratio for predicting diabetes, hypertension and lipidemia. Bangladesh Med Res Counc Bull. 2003;29:1-10.
-
Minsal. Ministerio de Salud, Gobierno de Chile. Guía clínica diabetes mellitus tipo 2. Santiago: Minsal, 2010. 2010.
-
Dr. Hugo Poblete Badal. Registro de Diálisis. XXVIII Cuenta de Hemodiálisis Crónica (HDC) en Chile. Al 31 de Agosto de 2008 [database on the Internet] 2008.
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista Digital · Año 17 · N° 169 | Buenos Aires,
Junio de 2012 |
|