
|
|||
|---|---|---|---|
|
|
Ejercicio físico y salud ósea |
|
|
|
*Departamento de Ciencias de la Actividad Física Universidad de Los Lagos, Osorno **Celular Physiology Laboratory, Biomedical Department Faculty of Health Sciences, Universidad de Antofagasta |
MSc. Rodrigo Ramírez Campillo* Lic. David Cristóbal Andrade** (Chile) |
|
|
|
Resumen Este artículo tiene como propósito realizar una revisión de literatura referente a la respuesta osteogénica frente a ejercicio físico. Aún se requiere mayor investigación para clarificar el rol del ejercicio en el metabolismo óseo, junto con las diferentes variables que podrían influir en este y como el ejercicio puede afectar esta relación. Se exhiben posibles limitaciones que podría presentar una evaluación ósea mediante absorciometría de rayos X de energía dual (DXA). Se concluye que el ejercicio en edades tempranas (aparte de las clases obligatorias de educación física), de alto impacto (basquetbol, voleibol, etc.), podría ser un factor particularmente protector de la salud ósea poblacional. Palabras clave: Hueso. Densidad mineral ósea (BMD). Contenido mineral óseo (BMC). Ejercicio. Osteogénesis.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires - Año 17 - Nº 169 - Junio de 2012. http://www.efdeportes.com/ |
|
|
1 / 1
Introducción
La osteoporosis es uno de los mayores problemas de salud pública (Maımoun, L., et al. 2005). Esta implica una reducción de la masa ósea y una micro-arquitectura ósea alterada (Maımoun, L., et al. 2005). Esta se consideraba una enfermedad de la vejes, pero actualmente prevalecería también en personas más jóvenes, especialmente mujeres (Burrows, M., et al. 2003). Al ser un problema de salud pública, la investigación y la utilización de regímenes de ejercicios apropiados, destinados a maximizar la respuesta osteogénica (prevención y/o tratamiento), estaría bien justificada. A pesar de esto, la investigación relacionada con la óptima relación entre actividad física y salud ósea no ha llegado a conclusiones consistentes (Maımoun, L., et al. 2005). Para enfrentar la situación se requiere una mayor (y más precisa) definición de las especificaciones biomecánicas, como bien de la intensidad, duración y frecuencia del ejercicio al ser prescrito (Maımoun, L., et al. 2005), ayudando a que los recursos se optimicen, generando así estrategias de intervención más efectivas-eficientes.
Regulación hormonal, bioquímica y su relación con la salud ósea
El metabolismo óseo sería influenciado por muchos factores (Uzunca, K, et al. 2005), como las hormonas (Sinnesael, M. et al. 2011; Maımoun, L., et al. 2005; Guadalupe-Grau, A. et al. 2009), micronutrientes (Burrows, M. et al. 2003) y elementos ionizados (Maımoun, L., et al. 2005).
Osteocalcina (OC)
23 damas y 43 varones estudiantes de educación física, fueron divididos al azar en 2 grupos: entrenamiento (GT, n=28) y control (GC, n=38). El GT fue sometido a entrenamiento de fuerza, combinado con saltos pliométricos, durante 9 semanas. El grupo control no entrenó. Se midió composición corporal (DXA) y hormonas en suero. Al iniciar el entrenamiento se observó una correlación positiva entre los niveles de OC y BMC, masa magra, fuerza dinámica, y concentraciones de testosterona libre en suero. Por otro lado, la OC se correlacionó negativamente con cortisol en suero, porcentaje de grasa, masa grasa y con las concentraciones de leptina. Los niveles de OC fueron superiores en hombres vs. mujeres. La OC aumentó 45% y 27% para hombres y mujeres, respectivamente (p<0,05). Además, un alto porcentaje de las cabezas pesadas de miosina (MHC) de la isoforma II, podrían predecir el incremento en las concentraciones de OC en suero basal, tras un entrenamiento de fuerza (Guadalupe-Grau, A. et al. 2009). Se puede observar que, la OC se relacionó positivamente con los niveles de testosterona y BMC, por tanto se podría teorizar que si se llegaran a aumentar los niveles de estas hormonas se podría ver beneficiado BMC y BMD, tal vez en el largo plazo. Sin embargo, la respuesta aguda de OC frente a ejercicio no es clara. La reabsorción y síntesis ósea, se ha relacionado con los marcadores colágeno tipo1 C-telepeptido (CTX) y OC, respectivamente. Tras un ejercicio máximo incremental, no se observaron modificaciones significativas en estos marcadores bioquímicos (Maımoun, L., et al. 2005). Esto podría deberse a la corta duración del estímulo (8 a 12 min) (Maımoun, L., et al. 2005).
Andrógenos y estrógenos
La testosterona tendría un rol en la regulación del contenido óseo en el hombre (Sinnesael, M. et al. 2011). Esta sería el mayor andrógeno circulante en el hombre, derivado del colesterol. La testosterona gonadal y adrenal podría ser convertida en estrógenos (C18 esteroides) por la P540 aromatasa (CYP19), presente en muchos tejidos, incluido el hueso (Sinnesael, M. et al. 2011). Las células óseas presentarían receptores androgénicos (AR), como también receptores estrogénicos α (ERα) y β (ERβ) (Sinnesael, M. et al. 2011). Así, la acción androgénica en el hueso de un varón estará mediada por los AR, mientras que la acción estrogénica sería mediada por receptores ERα–β (Sinnesael, M. et al. 2011). Alteraciones en los AR o ERα–β podrían explicar alteraciones óseas en la zona cortical y/o periostial (Sinnesael, M. et al. 2011). El estradiol y la testosterona en suero, estarían inversamente relacionados con el riesgo de fractura en varones ancianos (Sinnesael, M. et al. 2011). El entrenamiento podría relacionarse con los niveles de testosterona. Así, bajos niveles de esta hormona estarían relacionados significativamente a elevados volúmenes de entrenamiento, sin embargo, los niveles hormonales no explicarían las diferencias de masa ósea entre sujetos que entrenaron con un volumen de 64-80km/semana, sujetos que entrenaron con un volumen de 95km/semana y sujetos que no entrenaron (MacKelvie, K, et al 2000). En mujeres bailarinas, la disminución de su BMD en espina lumbar se podría explicar por su gran sensibilidada un estado hipo-estrogénico (Keay, N., et al.1997). La principal causa de la osteoporosis pre- menopáusica en deportes femeninos podría ser la hipo-estrogenia, asociada con amenorrea hipotalámica (Sparling, P., et al. 1998). Así, durante un tratamiento con estrógenos, el área cortical se expandiría y como resultado habría expansión periostial (Sinnesael, M. et al. 2011), explicándose por un incremento en la dimensión periostal o por una reducción en la expansión endiostal (McKay, H.A., et al. 2005).
Hormona paratiroidea
Se ha observado que al realizar un test de ejercicio máximo incremental, este induciría una variación significativa en los parámetros de la homeostasis del Ca (Maımoun, L., et al. 2005). Un aumento en los niveles de la hormona paratiroidea en suero, podría reflejar directamente el descenso en los niveles de Ca+ en suero, siendo el principal regulador del factor de secreción de la hormona paratiroidea (Maımoun, L., et al. 2005). Esto podría ser por el exceso de fosfatos inorgánicos (Pi) (Levy, M. N., et al. 2006), ya que este (por la contracción muscular), podrían unirse al Ca, lo cual llevaría a una disminución de la absorción intestinal de Ca, por una disminución de la acción de la hormona paratiroidea (Levy, M. N., et al. 2006). La acción de los Pi (Robergs, R.A. 2003) puede verse reflejada por la acidosis metabólica inducida por el test de ejercicio máximo incremental, el cual puede ser el principal factor que induzca un disturbio en el metabolismo del Ca (Maımoun, L., et al. 2005). Experimentos en animales han demostrado que la administración intermitente de hormona paratiroidea incrementaría la masa del hueso y mejoraría la micro-arquitectura trabecular y una continua administración por infusión podría traducirse en una conexión de pérdida de masa ósea y alteraciones en la estructura del hueso (Tam, C.S. et al. 1982, citado por Maımoun, L., et al. 2005). Por ende, un aumento transitorio en los niveles de la hormona paratiroidea, podría tener un efecto potencial anabólico en la salud del hueso (Maımoun, L., et al. 2005).
Micronutrientes y macronutrientes
Si bien el ejercicio podría impactar favorablemente la salud ósea, una dieta deficiente podría impactar negativamente esta relación. Un bajo consumo dietario de micronutrientes como magnesio (Mg) y zinc (Zn) podrían afectar negativamente la BMD (Burrows, M. et al. 2003). Además, un bajo consumo de Mg podría disminuir la secreción de hormona paratiroidea, alterando los procesos de remodelación ósea (Burrows, M. et al. 2003). También, un consumo excesivo de proteínas (habitual entre la población deportiva) podría resultar en una incrementada pérdida de calcio (Wolf, R.R., 2000).
Estudios transversales y longitudinales apoyan el rol del ejercicio en la salud ósea
El equipo femenino olímpico de hockey de los Estados Unidos (sus integrantes presentaban un estado eumenorreico), quienes se preparaban para los Juegos Olímpicos de 1996, presentaron un BMD de 1,253 ± 0,048 g/cm2 (13% superior vs. normativa estándar) (Sparling, P., et al. 1998). En una investigación se estudió a 24 ex jugadores de futbol profesional, menores de 70 años de edad (para clasificarse como futbolista profesional, los sujetos debían haber entrenado entre 12 a 14 horas/semana, durante 40 semanas/año), retirados hace 10 años. Los sujetos fueron comparados con un grupo control (n=25) de no deportistas. La BMD fue significativamente superior en los ex futbolistas vs. no deportistas, a nivel de espina lumbar, cabeza femoral, trocánter femoral, tibia distal y hueso calcáneo (Uzunca, K, et al. 2005). Un estudio tuvo como propósito investigar el nivel de mineralización ósea en sujetos sometidos a entrenamiento de remo (deporte que implica la utilización de grandes grupos musculares). 17 sujetos se sometieron a un programa de entrenamiento de 7 meses, donde realizaban 8 horas de remo a la semana, 1 hora de pesas en la semana (enfatizando a los músculos utilizados para remar) y 1 hora de carrera en la semana, los cuales fueron comparados con un grupo control. La BMD y BMC se midió mediante DXA en la espina lumbar, cuello femoral y trocánter mayor. No se observaron diferencias significativas en BMD y BMC antes de iniciar el entrenamiento. La BMD de la espina lumbar en el grupo de remeros aumentó significativamente (2,9% p=<0,001) vs. grupo control. Los otros lugares de medición no sufrieron una modificación estadísticamente significativa. El BMC en la espina lumbar aumentó significativamente (4,2% p=<0,001) en los remeros vs. grupo control. En las demás zonas medidas no se observaron modificaciones significativas en BMC (Cohen, B, et al, 1995). En un estudio de intervención, denominado “Bounce at the bell”, 51 niños de cuarto y quinto grado fueron sometidos a 8 meses de entrenamiento de saltos, 2 sesiones/semana, 30 saltos/día, comparándolos con un grupo control de 71 sujetos. Mediante DXA, se determinó que antes de iniciar el estudio no existían diferencias significativas entre los grupos en BMC (espina lumbar, cuello femoral, trocánter mayor, subregión inter-trocántica). Al finalizar los 8 meses de intervención, el grupo que fue intervenido obtuvo modificaciones significativas en BMC en fémur proximal (todos datos fueron ajustados a la masa corporal de los sujetos) (McKay, H.A., et al. 2005).
Importancia del momento de iniciar la intervención ¿cuando impactar?
El hueso es un tipo de tejido conectivo que se caracteriza por tener una sustancia intercelular calcificada, teniendo tres tipos de célula: osteoblastos (relacionadas con la formación del hueso), osteocitos (relacionadas con la mantención del tejido vivo) y osteoclastos (relacionadas con la reabsorción del hueso) (Cingolani, H.E., et al. 2000). Por otro lado, el medio intracelular se denomina matriz ósea, siendo sus principales componentes el colágeno tipo 1 y la osteocalcina (OC), la cual es una proteína no colágena formada en los osteoblastos. Además, un hueso adulto promedio se compone de 24% de calcio (Cingolani, H.E., et al. 2000). Al contrario de lo que muchas personas creen, el hueso es un tejido metabólico activo, con continuas remodelaciones (Cohen, B, et al, 1995), lo cual podría predisponerlo a una mayor osteogénesis en ciertos instantes a lo largo de la vida (Vicente-Rodríguez, G., et al. 2005). En las pasadas décadas se han diseñado pruebas experimentales que han demostrado que los ejercicios de salto, durante la niñez, aumentarían la mineralización (Cohen, B., et al, 1995; Uzunca, K., et al. 2005) y por ende la salud ósea (McKay, H.A., et al. 2005), planteándose que los mecanismos estimulantes serían la tensión muscular y la fuerza de gravedad (Cohen, B, et al, 1995). Mujeres japonesas que se ejercitaban en actividades extracurriculares durante su edad escolar, presentaban mayor BMD que las que no lo hacían. Los autores enfatizaron que la actividad física durante la primaria y la secundaria podría aumentar la BMD y los que realizan ejercicios de alto impacto podrían mantenerla por más tiempo (Hara, S., et al. 2001). En esta investigación se designaron de alto impacto los siguientes deportes: basquetbol, voleibol, hándbol, tenis, karate, atletismo pista y campo, futbol y footing (Hara, S., et al. 2001). Otros autores dividen a los deportes en 3 categorías, basados en el grado de carga mecánica impuesta por estos (figura 1). Además del ejercicio, la dieta (consumo de calcio) podría tener un rol particularmente relevante en la infancia vs. edades superiores (Hara, S., et al. 2001).

Figura1. Clasificación de 46 deportes, divididos en tres grupos basados en el grado de carga mecánica en los deportes (Modificado de Sparling, P. et al. 1998)
¿Cómo impactar?
Como se indicó recién, los ejercicios o actividades deportivas podrían ser clasificadas en función del impacto que ofrezcan al sistema musculo esquelético. Los estudios en general concuerdan en que las actividades de alto impacto ofrecerían ventajas por sobre las de bajo impacto. Un estudio evidenció que la BMD fue significativamente (p=<0,001) superior en atletas (1,21 ± 0,09 g/cm2) que en no atletas (1,18 ± 0,08 g/cm2) y significativamente superior (p=<0,001) en atletas que realizaban deportes de alto impacto vs. los que realizaban deportes de medio y bajo impacto. Además, es más frecuente observar una baja BMD en sujetos no entrenados (28,3%) vs. entrenados (10,7%) (Torstveit, M.K. Sundgot-Borgen, J. 2005). En el ámbito deportivo se ha postulado que el ejercicio de endurance desplegaría un efecto protector en contra de la perdida de hueso (Burrows, M. et al. 2003). Veinte corredores de distancia competitivos, los cuales tenían una experiencia de más de 20 años, fueron divididos en corredores de alto volumen (n=7, 64 a 80 km/semana), corredores de muy alto volumen (n=5, 95 a 112 km/semana) y un grupo control. Se midió BMD con DXA, testosterona libre y en suero, consumo dietario y mediciones antropométricas. Respecto a BMD en espina lumbar y fémur proximal, no se observaron diferencias entre los grupos. Los autores encontraron una correlación negativa entre testosterona libre y volumen de entrenamiento (MacKelvie, K, et al 2000). Sin embargo, el nivel de testosterona no explicaría el nivel de BMD, sugiriendo un rol del impacto/volumen sobre el hueso. Es interesante señalar que deportistas con disrupción menstrual, que participaban en deportes de alto impacto, presentaron mayor BMD vs. deportistas con disrupción menstrual que participaban en deportes de medio y bajo impacto (Torstveit, M.K. Sundgot-Borgen, J. 2005). Un estudio comparó a 13 gimnastas, 26 nadadores y 19 sujetos que no entrenaban (control). Se midió la BMD mediante DXA en la espina lumbar, hueso femoral y el hueso trocánter. Cuando se ajustó a la superficie del cuerpo, no hubo diferencias entre nadadores y gimnastas en masa magra, pero si entre deportistas vs. no deportistas (p=<0,01). Los gimnastas presentaron una masa grasa más baja (p=<0,005) que los nadadores y el grupo control. Los gimnastas presentaron una elevada BMD en el hueso femoral (1.117 ± 0,110) en comparación con el grupo control (0,974 ± 0,105), y estos últimos presentaron una BMD mayor que los nadadores (0,875 ± 0,105). La BMD del trocánter también fue más elevada en los gimnastas (0,898 ± 0,130) que en el grupo control (0,784 ± 0,097) y los nadadores (0,748 ± 0,085). Los autores sugirieron que las altas cargas de impacto a las que se verían sometidas las gimnastas, serían un potente estimulo osteogénico, mientras que la natación no ofrecería beneficios para la densidad ósea de mujeres jóvenes (Taaffe D.R. et al. 1995). Otros autores también concuerdan en que los ejercicios de mayor impacto podrían ofrecer ciertas ventajas por sobre los de menor impacto en cuanto a BMD (Burrows, M. et al. 2003).
¿Dónde impactar?
Además del momento y del tipo de actividad a realizar, es importante considerar que regiones corporales se pretenden impactar, pues la adaptación ósea es altamente específica, es decir, solo se conseguirán adaptaciones en las regiones óseas que se vean involucradas en la actividad realizada. En jugadores de tenis, la BMD del radio del brazo con el que jugaban (1,37 g/cm2) era mayor comparada con la del brazo que no jugaban (1,23 g/cm2) (Huddleston AL, et al. 1980). En otro estudio se comparó el BMC de 11 jugadoras de voleibol, que entrenaban aproximadamente 8 horas/semana vs. 11 mujeres no activas. Mediante DXA, se midió la zona distal y proximal de húmero para la BMC y la zona distal del radio para la BMD. Las jugadoras de voleibol presentaron un mayor (p=<0,05) BMC del humero proximal del brazo dominante comparado con el grupo de sujetos no activos, pero no se encontraron diferencias entre los grupos en BMC del humero distal y BMD del radio distal. En las jugadoras de voleibol, el BMC era significativamente superior en brazo dominante vs. no dominante. En el grupo no activo no se observaron diferencias significativas entre el brazo dominante y no dominante (Alfredson H, et al. 1998). Un estudio con tenistas, observó que la masa del brazo dominante (BMC + grasa + masa magra) era 20% mayor vs. brazo no dominante. En contraste, no se observan diferencias significativas en BMC y BMD entre los brazos de un grupo control. La masa total, masa magra y BMC fueron mayores en el brazo dominante en el grupo que entrenaba tenis vs. el grupo control (p=<0,05). La BMD de la espina lumbar, ajustado a la masa y estatura del cuerpo, fue 15% mayor en el grupo que entrena tenis vs. grupo control (P=<0,05). Lo mismo ocurrió en el hueso femoral (10-15% mayor en grupo tenis vs. grupo control, p=<0,05). Así, las diferencias observadas en la masa o densidad ósea pueden ser relacionadas al tipo de carga que se somete al esqueleto. Esto demuestra que la especificidad del ejercicio es importante al momento de planificar ejercicios destinados a mejorar la salud ósea, pues los segmentos que están sometidos a tensión serán los que reciban mayor estimulación (Uzanca, K., et al. 2005).
Masa magra, entreno con sobrecarga y salud ósea
Se ha observado una correlación entre masa corporal y BMD (Burrows, M. et al. 2003; Keay, N., et al. 1997) (a mayor masa corporal, mayor BMD, y viceversa). Esto podría sugerir que un aumento en la masa corporal (sin importar si es masa grasa) podría beneficiar la BMD. Pese a esto, otros autores no estarían de acuerdo, y han plateado quela masa magra podría ser el mejor predictor del contenido mineral óseo (BMC) y BMD, mientras que la masa grasa no presentaría ninguna relación con el desarrollo óseo (Vicente-Rodríguez, G., et al. 2005). Esto podría sugerir una importancia particular para el entrenamiento con sobrecargas y su impacto en la masa magra. En un estudio, 42 pre-púberes fueron divididos en dos grupos: grupo clases obligatorias de educación física (COEF, n=16, 80-90 min/semana) y grupo clases obligatorias de educación física + actividades extracurriculares (COEF+AE, n=26, 80-90 min/semana + 180 min/semana de futbol). Mediante DXA se determinó que el BMC era mayor en COEF+AE vs. COEF, sobre todo a nivel de fémur proximal. Se observó una correlación significativa (p<0,001) entre masa magra, BMC (r=0,67) y BMD (r=0,69) a nivel de fémur, y entre hueso femoral total y masa corporal total (r=0,65, p=<0,005). No se encontró correlación entre la masa grasa y masa ósea (Vicente-Rodríguez, G., et al. 2005). A pesar de estos resultados, estas relaciones aún no se comprenden totalmente (Maımoun, L., et al. 2005; Cohen, B, et al, 1995), sin embargo, apuntan hacia un rol de la masa magra en cuanto a la salud ósea. Considerando que ciertos ejercicios podrían ser más adecuados para mejora la masa magra, como el entrenamiento con sobrecarga, podría considerarse como otra herramienta terapéutica para optimizar la salud ósea.
Absorciometría de rayos X de energía dual (DXA)
Se recomienda que al revisar los estudios reportados en la literatura para considerar el impacto de intervenciones de ejercicio físico sobre la salud ósea, se consideren las limitaciones de las herramientas utilizadas para evaluar las variables óseas. El BMC y BMD son usualmente determinados mediante absorciometría de rayos X de energía dual (DXA), la cual permite su determinación a nivel de cuerpo entero y según segmentos corporales específicos (brazos, piernas, etc.). Sin embargo, algunos investigadores han señalado que esta tecnología presentaría ciertas limitaciones (McKay, H.A., et al. 2005; Turner, C.H., Robling, A.G. 2005). Por ejemplo, la tecnología DXA no sería apropiada para determinar BMD real o la densidad mineral ósea volumétrica (vBMD, usualmente expresada en g/cm3), pues solo permite determinar el área de la densidad mineral ósea (aBMD) (Vicente-Rodríguez, G., et al. 2005). Asimismo, el escáner DXA solo mediría en dos dimensiones, pero el hueso es un objeto tridimensional. Por tanto, en el escáner se observaría el largo y el ancho, pero no su profundidad (Vicente-Rodríguez, G., et al. 2005). A pesar de esto, es comúnmente aceptado su uso. La región más común de medición con DXA es el fémur proximal (cuello femoral, triangulo de Ward, región del trocánter y región inter-trocántica) (figura 2).
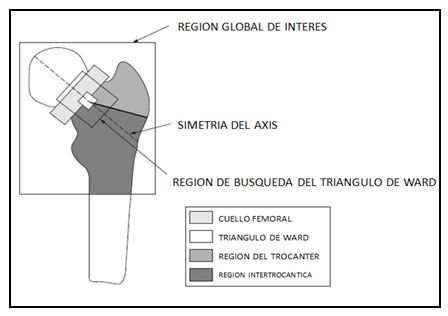
Figura 2. Diagrama del fémur proximal, en relación al análisis con densitometría ósea (DXA), mostrando la
región global de interés y las sub-regiones a analizar (Modificado de Vicente-Rodríguez, G., et al. 2005)
Conclusiones
El ejercicio físico podría ser una herramienta útil para generar modificaciones positivas en el metabolismo óseo. Sin embargo, las intervenciones con ejercicio aplicadas en las investigaciones reportadas en la literatura son bastante variadas, observándose así que aun no existe consenso con respecto a la mejor estrategia para generar modificaciones óseas significativas (Maımoun, L., et al. 2005). Es más, los estudios de intervención longitudinales, son relativamente escasos. A pesar de esto, ciertos principios básicos pueden ser considerados al momento de intervenir: a) iniciar temprano la intervención de ejercicio, b) utilizar ejercicio de alto impacto, c) impactar de forma específica las regiones óseas que se pretenden modificar, d) incluir ejercicios que favorezcan el desarrollo de la masa muscular. Finalmente, se recomienda que las actividades destinadas a favorecer la salud ósea, se mantengan durante toda la vida.
Aplicaciones prácticas
La utilización de actividades deportivas de alto impacto en edades tempranas, podría ser una herramienta apropiada para desarrollar una mayor osteogénesis en etapas prepuberales, la cual puede ser mantenida a lo largo de la vida, disminuyendo así uno de los mayores problemas actuales de la salud pública, enfatizando de esta forma la prevención y no en el tratamiento de una enfermedad.
Referencias
-
Alfredson, H., Nordstrom, P., Pietila, T. et al. Long-term loading and regional bone mass of the arm in female volleyball players. Calcif Tissue Int 62(4):303–8 1998.
-
Burrows, M, Nevill, A, Bird, S, and Simpson, D. Physiological factors associated with low bone mineral density in female endurance runners. Br J Sports Med 37:67–71 2003.
-
Calbet JA, Moysi JS, Dorado C, et al. Bone mineral content and density in professional tennis players. Calcif Tissue Int 62(6):491–6 1998.
-
Cingolani, H.E., Houssay, A.B. Fisiología humana de Houssay. Buenos Aires; El Ateneo, Pp. 597. 2000.
-
Cohen, B, Millett, P, Mist, B, Laskeyt, M, and Rushton, N. Effect of exercise training programme on bone mineral density in novice college rowers. Br. J. Sp. Med., Vol. 29, No. 2, pp. 85-88, 1995.
-
Guadalupe-Grau, A., Perez-Gomez, J., Olmedillas, H., Chavarren, J., Dorado, C., Santana, A., Serrano-Sanchez, J.A., and Calbet, L. Strength training combined with plyometric jumps in adults: sex differences in fat-bone axis adaptations. J Appl Physiol 106: 1100–1111, 2009.
-
Hara, S. Yanagi, H. Amagai, H. Endoh, K. Tsuchiya, S and Tomura, S. Effect of Physical Activity During Teenage Years, Based on Type of Sport and Duration of Exercise, on Bone Mineral Density of Young, Premenopausal Japanese Women. Calcif Tissue Int 68:23-30 2001.
-
Huddleston AL, Rockwell D, Kulund DN, Harrison RB. Bone mass in lifetime tennis athletes. JAMA 244: 1107-9 1980.
-
Keay, N, Fogelman, I, and Blake, G. Bone mineral density in professional female Dancers. BrJ'Sports Med 31:143-147 1997.
-
Levy, M. N. Stanton, B. A. Koeppen, B. M. Berne y Lev, fisiologia. Cuarta edición. Pp.402. Elsevier. Madrid, 2006.
-
Maımoun, L., Simar, D., Malatesta, D., Caillaud, C., Peruchon, E., Couret, L., Rossi, M., and Mariano-Goulart, D. Response of bone metabolism related hormones to a single session of strenuous exercise in active elderly subjects. Br J Sports Med 39:497–502 2005.
-
MacKelvie, K, Taunton, J, McKay, H, Khan, K. Bone mineral density and serum testosterone in chronically trained, high mileage 40–55 year old male runners. Br J Sports Med 34:273–278 2000.
-
McKay, H.A., MacLean, L., Petit, M., MacKelvie-O’Brien, K., Janssen, P., Beck, T., and Khan M.K. “Bounce at the Bell”: a novel program of short bouts of exercise improves proximal femur bone mass in early pubertal children. Br J Sports Med 39:521–526 2005.
-
Robergs, R.A. Acidosis metabólica inducida por el ejercicio: ¿de donde vienen los protones? PubliCE.09/01/03. pid:68.
-
Sparling, P., Snow, T., Rosskopf, L., O’Donnell, E., Freedson, P., and Byrnes W. Bone mineral density and body composition of the United States Olympic women’s field hockey team. Br J Sports Med 32:315–318 1998.
-
Sinnesael, M., Boonen, S., Claessens, F., Gielen, E., and Vanderschueren D. Testosterone and the Male Skeleton: A Dual Mode of Action. J Osteoporos. 2011: 240328 2011.
-
Taaffe DR, Snow-Harter C, Connolly DA, et al. Differential effects of swimming versus weight bearing activity on bone mineral status of eumenorrheic athletes. J Bone Miner Res 10(4):586–93 1995.
-
Torstveit, M.K. Sundgot-Borgen, J. Low bone mineral density is two to three times more prevalent in non-athletic premenopausal women than in elite athletes: a comprehensive controlled study. Br J Sports Med 39:282–287 2005.
-
Turner, C.H., Robling, A.G. Exercises for improving bone strength. Br J Sports Med 39:188–189 2005.
-
Uzunca, K, Birtane, M, Durmus-Altun, G, and Ustun, F. High bone mineral density in loaded skeletal regions of former professional football (soccer) players: what is the effect of time after active career?. Br J Sports Med 39:154–158 2005.
-
Vicente-Rodriguez, G., Ara, I., Perez-Gomez, J., Dorado, C., and Calbet J.A. Muscular development and physical activity as major determinants of femoral bone mass acquisition during growth. Br J Sports Med 39:611–616 2005.
-
Wolf, R.R. Protein supplements and exercise. Am J Clin Nutr 72(suppl):551S-7S, 2000.
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista Digital · Año 17 · N° 169 | Buenos Aires,
Junio de 2012 |
|