
|
|||
|---|---|---|---|
|
|
Proteínas de estresse ‘HSPs’ como complemento do sistema de defesa antioxidante Las proteínas de estrés ‘HSPs’ como complemento del sistema de defensa antioxidante Heat shock proteins as complement of the antioxidant defense system |
|
|
|
Doutor em Biologia Funcional e Molecular, Departamento de Bioquímica Instituto de Biologia, Universidade Estadual de Campinas, UNICAMP (Brasil) |
Joaquim Maria Ferreira Antunes Neto
|
| |
|
Resumo Vários trabalhos mostram que, para a resposta ao estresse, a expressão de proteínas de estresse - “heat shock proteins” (HSP) - torna-se essencial para a sobrevivência da célula, atuando estas também como integrantes de um sistema secundário de defesa antioxidante. Assim, análises de marcadores de estresse oxidativo em conjunto com a detecção de HSPs poderiam ser uma potente ferramenta para controlar a sobrecarga dos exercícios de treinamento, prevenindo a instalação de situações de indução de overtraining. Unitermos: Proteínas de estresse. Estresse oxidativo. Exercício físico.
Abstract Many studies has clearly shown that the stress response, and in particular the stress protein - heat shock protein (HSP) -expression, are essential for the survival of the cell confronted with a particular environmental insult. Oxidative stress markers analyses and HSP70 detection could be a useful tool to control the overload of training exercises preventing the installation of overtraining situation. Keywords: Heat shock proteins. Oxidative stress. Physical exercise.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires, Año 17, Nº 167, Abril de 2012. http://www.efdeportes.com/ |
|
|
1 / 1
Introdução
Células de todos os organismos respondem a uma variedade de condições estressantes através de uma rápida transcrição e subseqüente tradução de uma série de proteínas altamente conservadas, denominadas genericamente de proteínas de estresse (Locke et al., 1990). O termo “proteína de estresse” tem caráter genérico na descrição de eventos biológicos, uma vez que diferentes estímulos podem induzir o mesmo mecanismo de defesa celular (Welch, 1993). As Heat Shock Proteins (HSPs) surgem na literatura como uma das classes de proteínas de estresse melhor estudadas.
O aumento na expressão das HSPs foi inicialmente evidenciado em Drosophila melanogaster, por meio de choque térmico (incubação em diferentes temperaturas elevadas). Hoje já se conhece que a resposta heat shock é uma propriedade geral de todas as células, tanto em condição de hipertermia quanto de demais estados de alteração homeostática, tais como exposição a metais pesados, aumento na concentração de cálcio intracelular, diminuição de glicose para fornecimento de energia às células, infecções virais e bacterianas, hipóxia, análogos de aminoácidos, aumento de espécies reativas de oxigênio (EROs), presença de toxinas, etc. (Schlesinger, 1986; Bienz, Pelham, 1987; Welch, 1992; Yellon, Marber, 1994).
Função das proteínas de estresse
As HSPs são de fundamental importância para a sobrevivência das células, não apenas em condição de estresse, onde se vê aumento na síntese de proteínas dirigidas à reparação de danos celulares, mas também em eventos de transporte e enovelamento (folding) de proteínas em formação (Neupert et al., 1990; Gething, Sambrook, 1992; Craig, 1993; Morimoto, 1993; Stuart et al., 1994; Terlecky, 1994). Por isso, são também denominadas de “chaperonas moleculares” (Flaherty et al., 1990; Hendrick, Hartl, 1993; Hall, 1994). Algumas classes de proteínas de estresse são constitutivas, sendo denominadas de proteínas cognatas. As proteínas cognatas são membros constitutivos de famílias de proteínas de estresse que funcionam em condição fisiológica normal. Por exemplo, a Hsc70 é uma proteína cognata da classe HSP70. As famílias de proteínas com pesos moleculares de 72 kDa, 73 kDa e 90 kDa correspondem às maiores classes de proteínas de estresse expressas pelo organismo (Welch et al., 1983).
As chaperonas moleculares podem ser definidas como uma categoria de proteínas que assessoram a formação correta de outros polipeptídios, embora não sejam componentes próprios da estrutura funcional normal destes (Ellis, Van Der Viés,1991). O grande problema de proteínas em formação e daquelas recém-sintetizadas é a exposição de suas superfícies interativas com o ambiente intracelular, que poderia facilitar contatos com outras moléculas, desencadeando alterações na conformação estrutural e funcional já programadas da proteína. As chaperonas moleculares têm como função principal assistir a autoformação e enovelamento de cadeias polipeptídicas, por inibição de vias alternativas de ligação de outras proteínas às cadeias que se formam, auxiliando na não formação destas interações incorretas. Os processos apresentados a seguir mostram a atuação geral de chaperonas em relação ao problema de superfícies interativas (Ellis, Van Der Vies, 1991):
-
Síntese de Proteínas. A região amino-terminal de cada polipeptídio é sintetizada antes da região carboxila-terminal, podendo, nesta condição, haver a atuação de chaperonas interagindo com a proteína em formação, com o objetivo de impedir interações incorretas de elementos da própria estrutura protéica ou com outros componentes celulares.
-
Transporte de Proteínas. Proteínas que adentram em organelas como retículo endoplasmático, mitocôndrias, plastídios e periplasmos bacterianos atravessam a membrana somente em um estado desdobrado ou semi-enovelado. As proteínas são sintetizadas por ribossomos citossólicos na forma de precursores, sendo que o transporte para o interior de determinada organela pode ser procedido apenas por intermédio de interação com uma chaperona.
-
Função Proteica. Em muitas situações, o funcionamento normal de complexos oligoméricos envolve mudanças em interações subunidade-subunidade, de forma que exposições transitórias de superfícies de contato destes complexos podem ser mediadas por chaperonas moleculares.
-
Resposta de Estresse. Estresse ambiental pode causar desnaturação de proteínas. Para a proteção contra o estresse imposto, as células acumulam proteínas que previnem a produção de agregados de proteínas desnaturadas.
Mecanismos de ação das proteínas de estresse
Vigh e equipe (1998) sugeriram também que alterações nas propriedades físicas (fluidez e viscosidade) de membranas biológicas pelo aumento na temperatura interna poderiam influenciar a expressão de genes heat shock. Contudo, esta resposta homeostática de organização da membrana parece ser transitória, com duração de poucas horas; o acúmulo de HSPs específicas nas regiões de alteração induziria um aumento na rigidez da membrana, a fim de que esta possa recuperar suas características normais de fluidez; após o restabelecimento das condições pré-estresse, a membrana inativaria os sinais de perturbação e finalizaria a síntese de HSPs. Nesse sentido, Ryan e colaboradores (1991) propuseram que a quantidade de proteínas de estresse HSP70 sintetizadas parece ser dependente da severidade do estresse submetido ao organismo e do nível celular de HSPs existente anteriormente à condição de estresse. Postularam também que a síntese de HSP70 em células expostas ao calor sofre uma redução quando as mesmas células são subseqüentemente expostas a um segundo estresse térmico. Tal condição adaptativa foi chamada de termotolerância adquirida (Gerner, Scheneider, 1975), sendo uma importante resposta de regulação térmica ambiental nos mamíferos. O início da atenuação das alterações celulares que podem ser induzidas pelo calor excedente parece ser dependente da presença de HSPs constitutivas no estado pré-estresse (Li et al., 1983).
E qual seria a natureza molecular dos “termômetros celulares” que sinalizam a transcrição das HSPs? Hightower (1991) descreveu três possíveis mecanismos:
-
Estudos com Escherichia coli revelaram que danos celulares são reparados em função de três HSPs - DnaK, DnaJ e GrpE, por aumentar a quantidade do “fator de transcrição heat shock s32”. A proteína de estresse DnaK é o homólogo bacteriano da família HSP70 eucariótica. Propõe-se que haja uma ligação entre o fator de transcrição s32 e as proteínas de estresse constitutivas, providenciando um complexo regulatório para monitorar a demanda de HSPs.
-
O ribossomo poderia ser um sensor de controle para respostas de estresse, gerando a síntese de cadeias polipeptídicas parcialmente dobradas. Tais cadeias polipeptídicas seriam identificadas como proteínas defeituosas ou desnaturadas, vindo a induzir a expressão de HSPs.
-
A regulação da transcrição das HSPs poderia ser controlada pelo fator heat shock (HSF), presente no citoplasma, que teria a capacidade de ligação com o elemento heat shock (HSE), situado no núcleo. Esta, aparentemente, é a hipótese mais aceita e está apresentada na Figura 1.
Segundo essa proposta, em condições homeostáticas normais as HSPs estão ligadas ao fator heat shock (HSF) (estágio 1). O HSF pode ser definido como um fator de ativação transcricional, presente no citoplasma em estado monomérico e sem atividade de ligação ao DNA. Em resposta a hipertermia ou a outra condição de estresse há um aumento de proteínas desnaturadas no citoplasma, induzindo um desacoplamento do complexo HSP-HSF. O desacoplamento ocorre em virtude das HSPs constitutivas buscarem ligação com as proteínas desnaturadas, pois sua função é prevenir que tais proteínas desnaturadas agreguem-se em interações deletérias com outras proteínas, que poderiam ocasionar uma condição de estresse maior (estágio 2).
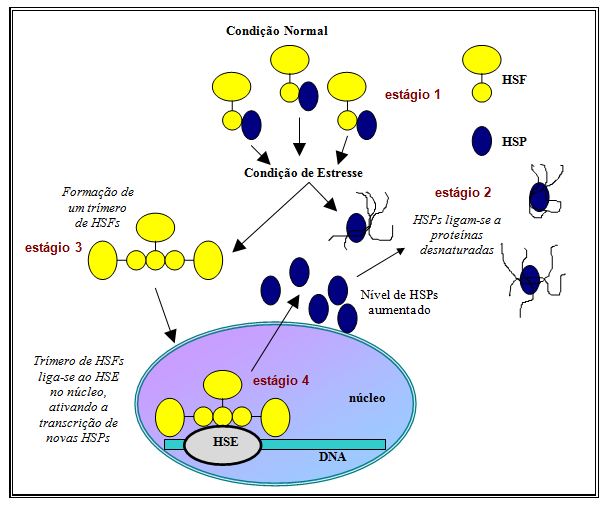
Figura 1. Modelo especulativo para a ativação do fator heat shock (HSF) em condição de estresse
Contudo, para que o HSF desencadeie o processo de síntese das HSPs, ele deve adentrar-se no núcleo celular e ligar-se ao elemento heat shock (HSE); a entrada do HSF no núcleo só é possível através de sua transição de um estado monomérico (desativado) para um estado oligomérico (ativado) (estágio 3). As HSPs regulam o estado de oligomerização do HSF (e assim sua capacidade de ligar-se ao DNA), através da ocultação da superfície de trimerização; uma vez havendo a ligação das HSPs constitutivas com proteínas desnaturadas no citoplasma, a superfície de trimerização fica exposta, tornando possível a formação de trímeros de HSF. Em um estágio subseqüente, ocorre a entrada destes trímeros no núcleo e a imediata ligação aos HSEs do DNA, ativando a transcrição das HSPs (estágio 4). A síntese de HSPs induzida por um estado de hipertermia é proporcional a duração e severidade do estresse (Storti et al., 1980; Didomenico et al., 1982; Lindquist, 1986; Sorger, 1991; Morimoto, 1993; Feige, Polla, 1994).
Proteínas de estresse e exercício físico
Sobre a atividade das proteínas de estresse em situação de exercício físico pouco se sabe ainda. Muitas condições bioquímicas e fisiológicas, juntamente com a elevação de temperatura poderiam estimular a expressão de proteínas de estresse no exercício, dentre elas depleção de glicose, hipóxia, concentração intracelular de Ca2+ elevada e decréscimo de pH (Locke et al., 1990). Existem evidências também que EROs, numa condição de estresse oxidativo, poderiam também participar como sinalizadores na síntese de HSPs (Welch, 1992). Hernando e Manso (1997) relataram que ratos sedentários submetidos ao exercício intenso tiveram aumentos significativos de HSP72 no músculo sóleo. Locke e colaboradores (1990) também mostraram que o estresse induzido por um exercício exaustivo em esteira seria um estímulo suficiente para induzir síntese de HSP72 e HSP90 em células do músculo sóleo, do baço e em linfócitos.
Dado o potencial das EROs danificarem proteínas intracelulares durante contrações musculares repetitivas, foi sugerido que quando essa produção exceder a capacidade de defesa, a síntese de HSPs poderia complementar a defesa enzimática antioxidante pré-existente do organismo (Essig, Nosek, 1997). Nesse sentido, Antunes Neto e colaboradores (2006) mostraram aumento na concentração de proteínas carboniladas e diminuição na atividade das enzimas antioxidantes catalase e glutationa redutase no músculo sóleo de ratos sedentários duas horas após um protocolo de exercício exaustivo, indicando que a exaustão estava relacionada com um aumento nos níveis de estresse oxidativo. Nesse mesmo tempo, detectou-se aumento significativo na expressão de HSP72 no músculo sóleo, reforçando a idéia de que a síntese de HSP poderia ser um mecanismo complementar de proteção contra o estresse oxidativo induzido pelo exercício quando o sistema enzimático antioxidante está com sua atividade diminuída (Smolka et al., 2000). A sinalização para a síntese de HSPs seria, possivelmente, a exposição de aminoácidos hidrofóbicos das próprias enzimas da defesa; os aminoácidos hidrofóbicos atuariam como regiões de ligação às HSPs, sinal para a síntese de mais proteínas de estresse.
Existem evidências experimentais de que apenas músculos compostos por fibras do tipo I apresentam expressão constitutiva de HSP70; músculos de fibras mistas contêm HSPs constitutivas de acordo com a proporção de fibras do tipo I existentes. O nível aumentado de HSP70 constitutivas em fibras do tipo I relaciona-se, possivelmente, ao fato destas fibras estarem continuamente sujeitas a condições mais estressantes do que outros tipos de fibras (Locke et al., 1991; Locke et al., 1994).
Considerações finais
Os processos de adaptação ao estresse imposto pelo exercício contínuo e repetitivo têm suas atividades regulatórias ocorrendo, preponderantemente, no intervalo de recuperação entre as sessões de treinamento (imediatamente após o exercício até 24 horas do término da atividade contrátil), por intermédio de expressão específica de genes que induzem síntese de HSPs (Neufer et al., 1998). Tais resultados revelam que a ação das HSPs é seqüencial após uma atividade contrátil contínua, sendo como um mecanismo de compensação celular aos possíveis danos ocasionados pelo estresse oxidativo, reforçando que o tempo de recuperação de uma sessão de treinamento para outra é de fundamental importância para a ocorrência dos processos anabólicos.
Referências bibliográficas
-
ANTUNES NETO JMF, TOYAMA MH, CARNEIRO EM, BOSCHERO AC, PEREIRA-DA-SILVA L, MACEDO DV. Circulating leukocyte heat shock protein 70(hsp70) and oxidative stress markers in rats after a bout of exhaustive exercise. Stress 2006; 09: 107-115.
-
BIENZ M, PELHAM HRB. Mechanism of heat-shock gene activation in higher eukaryotes. Advances in Genetics 1987; 24: 31-72.
-
CRAIG EA. Chaperones: helpers along the pathways to protein folding. Science 1993; 260: 1902-1904.
-
DIDOMENICO BJ, BUGAISKY GE, LINDQUIST S. The heat shock response is self-regulated at both the transcriptional and posttranscriptional levels. Cell 1982; 31: 593-603.
-
ELLIS RJ, VAN DER VIES SM. Molecular chaperones. Annuals Reviews of Biochemistry 1991; 60: 321-347.
-
ESSIG DA, NOSEK TM. Muscle fatigue and induction of stress protein genes: a dual function of reactive oxygen species? Canadian Journal of Applied Physiology 1997; 22: 409-428.
-
FEIGE U, POLLA BS. Heat shock proteins: the hsp70 family. Experimentia 1994; 50: 979-986.
-
FLAHERTY KM, DELUCA-FLAHERTY C, MCKAY DB. Three-dimensional structure of the ATPase fragment of a 70Kda heat-shock cognate protein. Nature 1990; 346: 623-628.
-
GERNER EW, SCHENEIDER MJ. Induced thermal resistance in HeLa cells. Nature 1975; 256: 500-502.
-
GETHING MJ, SAMBROOK J. Protein folding in the cell. Nature 1992; 355: 33-45.
-
HALL TJ. Role of hsp70 in cytokine production. Experimentia 1994; 50: 1048-1053.
-
HENDRICK JP, HARTL FU. Molecular chaperone functions of heat-shock proteins. Annuals Reviews of Biochemistry 1993; 62: 349-384.
-
HERNANDO R, MANSO R. Muscle fiber stress in response to exercise. European Journal of Biochemistry 1997; 243: 460-467.
-
HIGHTOWER LE. Heat shock, stress proteins, chaperones, and proteotoxicity. Cell 1991; 66: 191-197.
-
LI GC, MEYER JL, MAK JY. Heat-induced protection of mice against thermal death. Cancer Research 1983; 43: 5758-5760.
-
LINDQUIST S. The heat shock response. Annual Review of Biochemistry 1986; 55: 1151-1191.
-
LOCKE M, NOBLE EG, ATKINSON BG. Exercising mammals synthesize stress proteins. American Journal of Physiology 1990; 258: C723-C729.
-
LOCKE M, NOBLE EG, ATKINSON BG. Inducible isoform of HSP70 is constitutively expressed in a muscle fiber type specific pattern. American Journal of Physiology 1991; 261: C774-C779.
-
MORIMOTO RI. Cells in stress: transcriptional activation of heat shock genes. Science 1993; 259: 1409-1410.
-
NEUFER PD, ORDWAY GA, WILLIAMS RS. Transient regulation of c-fos, αB-crystallin, and hsp70 in muscle during recovery from contractile activity. American Journal of Physiology 1998; 274: C341-C346.
-
NEUPERT W, HARTL FU, CRAIG EA. How do polypeptides cross the mitochondrial membranes? Cell 1990; 63: 447-450.
-
RYAN AJ, GISOLFI CV, MOSELEY PL. Synthesis of 70K stress protein by human leukocytes: effect of exercise in the heat. Journal of Applied Physiology 1991; 70: 466-471.
-
SCHLESINGER MJ. Heat shock proteins: the search for functions. Journal Cell Biology 1986; 103: 321-325.
-
SMOLKA MB, ZOPPI CC, ALVES AA, SILVEIRA LR, MARANGONI S, PEREIRA-DA-SILVA L, NOVELLO JC, MACEDO DV. HSP72 as a complementary protection against oxidative stress induced by exercise in the soleus muscle of rats. American Journal of Physiology 2000; 279: R1539-R1545.
-
STORTI RV, SCOTT MP, RICH A. Translational control of protein synthesis in response to heat shock in D. melanogaster cells. Cell 1980; 22: 828-835.
-
STUART RA, CYR DM, NEUPERT W. Hsp70 in mitochondrial biogenesis: from chaperoning nascent polypeptide chains to facilitation of protein degradation. Experimentia 1994; 50: 1002-1011.
-
SORGER PK. Heat shock factor and the heat shock response. Cell 1991; 65: 363-366.
-
TERLECKY SR. Hsp70s and lysosomal proteolysis. Experimentia 1994; 50: 1021-1025.
-
VIGH L, MARESCA B, HARWOOD JL. Does the membrane’s physical state control the expression of heat shock and other genes? TIBS 1998; 23: 369-374.
-
WELCH WJ. How cells respond to stress. Scientific American 1993; 268: 34-41.
-
WELCH WJ. Mammalian stress response: cell physiology, structure/function of stress proteins, and implications for medicine and disease. Physiological Reviews 1992; 72: 1063-1081.
-
WELCH WJ, GARRELS JI, THOMAS GP. Biochemical characterization of the mammalian stress protein and identification of two stress proteins as glucose-and Ca2+-Ionophore-regulated proteins. Journal of Biological Chemistry 1983; 258: 7102-7111.
-
YELLON DM, MARBER MS. Hsp70 in myocardial ischaemia. Experimentia 1994; 50: 1075-1083.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista
Digital · Año 17 · N° 167 | Buenos Aires,
Abril de 2012 |
|