
|
|||
|---|---|---|---|
|
|
Tecido adiposo como regulador da inflamação e da obesidade El tejido adiposo como regulador de la inflamación y de la obesidad |
|
|
|
*Nutricionista, Ms. em Ciência da Nutrição pelo Programa de Pós-Graduação Ciência da Nutrição Stricto Sensu Departamento de Nutrição e Saúde, Universidade Federal de Viçosa, UFV **Professor Titular, Departamento de Nutrição e Saúde Universidade Federal de Viçosa - UFV Programa de Pós-Graduação em Ciência da Nutrição |
Josie de Souza Oliveira* Josefina Bressan** (Brasil) |
|
|
|
Resumo A obesidade é uma doença crônica crescente que afeta indivíduos de todas as idades e grupos socioeconômicos. Até pouco tempo o tecido adiposo era visto apenas como local de reserva energética, protetor contra choques e isolante térmico. Entretanto, atualmente, é visto como um órgão dinâmico devido às inúmeras adipocinas secretadas, evidenciando suas funções inflamatória e endócrina, o que caracteriza a obesidade como estado de inflamação crônica de baixa intensidade. Objetivou-se discutir o papel do tecido adiposo na regulação da inflamação e da obesidade. Realizou-se uma busca empregando os termos: inflamação, tecido adiposo, obesidade, adiposidade abdominal, adipocinas, leptina e seus correspondentes em inglês, nas bases científicas eletrônicas: Science Direct, Medline, Highwire e SciELO, abrangendo os anos de 1999 a 2008. Tornou-se evidente pela revisão apresentada que o tecido adiposo é o regulador da inflamação e da obesidade e que, entre ambas, não há uma relação de causa e efeito, mas sim um ciclo vicioso. A hipóxia tem sido sugerida como processo inicial de indução das citocinas pró-inflamatórias, fazendo um link entre obesidade e inflamação que, por sua vez, promove a liberação de citocinas pró-inflamatórias envolvidas no desenvolvimento da obesidade. Ainda há muitos mecanismos a serem esclarecidos, já que as informações obtidas até então, indicam ser apenas a ponta de um “iceberg”. A compreensão minuciosa das funções endócrinas e inflamatórias do tecido adiposo possibilitará não apenas um tratamento mais eficaz como também a prevenção da obesidade e suas conseqüências. Unitermos: Tecido adiposo. Obesidade. Inflamação. Adipocinas.
|
|||
|
|
EFDeportes.com, Revista Digital. Buenos Aires, Año 15, Nº 150, Noviembre de 2010. http://www.efdeportes.com/ |
|
|
1 / 1
Introdução
A obesidade atingiu proporções epidêmicas, tanto em países desenvolvidos quanto naqueles em desenvolvimento, estando associada a taxas elevadas de mortalidade. Mais de 1 bilhão de adultos em todo o mundo apresentam sobrepeso e no mínimo 300 milhões de pessoas são obesas. A obesidade é uma doença crônica crescente que afeta indivíduos de todas as idades e grupos socioeconômicos1. Possui causa multifatorial, dentre elas estão a genética, o desequilíbrio entre ingestão alimentar e gasto energético por meio de atividade física, os fatores endócrinos, os mecanismos adaptativos associados a desordens e os tratamentos nutricionais, farmacológicos e comportamentais22,34, podendo esses fatores atuar de forma isolada ou concomitantemente.
Segundo dados da Pesquisa de Orçamentos Familiares 2002-2003 do IBGE2, no Brasil, o excesso de peso atinge 38,8 milhões de brasileiros com idade igual ou superior a 20 anos, representando 40,6% da população adulta, dos quais 10,5 milhões são considerados obesos.
Até relativamente pouco tempo, o papel da gordura em si no desenvolvimento da obesidade e suas conseqüências foi considerado passivo. O tecido adiposo, por muitos anos, foi visto somente como local de reserva energética, protetor contra choques e isolante térmico3,4,5. Entretanto, após a descoberta de inúmeras substâncias secretadas pelos adipócitos, dentre elas hormônios e citocinas, esse tecido passou a ser visto como órgão dinâmico e suas funções inflamatória e endócrina foram evidenciadas6,7,8.
Esta revisão objetivou discutir o papel do tecido adiposo na regulação do processo inflamatório e da obesidade.
Metodologia
Foi realizada uma busca empregando os seguintes termos: Inflamação, tecido adiposo, obesidade, adiposidade abdominal, adipocinas, leptina e seus correspondentes em inglês, nas bases científicas eletrônicas: SCIENCE DIRECT, MEDLINE, HIGHWIRE e SciELO, abrangendo os anos de 1999 a 2009, incluindo também os artigos pertinentes ao tema citados nos artigos previamente selecionados.
Tecido adiposo e inflamação
O tecido adiposo é composto adipócitos, pré-adipócitos, fibroblastos, células endoteliais, leucócitos, monócitos e macrófagos residentes6,9,5. Este tecido pode ser considerado patogênico quando o excesso da adiposidade corporal, de forma isolada ou associada aos efeitos deletérios de atividades endócrinas e imunológicas, está relacionado a desordens metabólicas9.
Segundo revisão feita por Trayhurn & Wood (20043) a obesidade é caracterizada como estado de inflamação crônica de baixa intensidade. A inflamação responde de forma diretamente proporcional ao aumento da adiposidade corporal. Ou seja, a maior infiltração de macrófagos em proporção ao aumento do tamanho dos adipócitos, pode aumentar a produção de citocinas pró-inflamatórias e proteínas de fase aguda, dentre elas a MCP-1 (proteína quimiotática de monócitos-1), já que tanto os adipócitos hipertrofiados quanto os macrófagos são capazes de secretar tais citocinas e, assim, contribuir com as conseqüências fisiopatosiológicas da obesidade10,6,11,8.
O acúmulo de gordura, principalmente visceral e a inflamação sistêmica estão associados a desordens metabólicas como obesidade, diabetes mellitus, hipertensão arterial, dislipidemias, aterosclerose e outras doenças cardiovasculares12,13,9.
Entretanto, fica ainda uma pergunta: O que induz a liberação das adipocinas pelo tecido adiposo, iniciando assim a inflamação? Segundo alguns autores3, 11 uma possível explicação seria a hipóxia sofrida pelo tecido adiposo devido à expansão desse tecido no desenvolvimento da obesidade (Figura 1).
Ye et al. (200711) realizaram estudo in vitro e com modelos animais a fim de fornecer evidências experimentais de que na obesidade existe a hipóxia e que esta pode contribuir com a inflamação crônica de baixa intensidade e hipoadiponectinemia. Para testar essa possibilidade, os autores usaram um grupo de genes relacionados à inflamação para avaliar a resposta inflamatória. No tecido adiposo de camundongos ob/ob, todos esses genes estiveram aumentados. Sendo o aumento desses genes e a redução da expressão de adiponectina observados junto à hipóxia. Assim, a hipóxia foi associada à inflamação crônica e à inibição da adiponectina in vivo e, in vitro, foi demonstrado que a hipóxia é capaz de induzir a expressão de citocinas pró-inflamatórias e o decréscimo de adiponectina no tecido adiposo de camundongos magros.
Trayhurn & Wood (20043) sugerem que os adipócitos hipertrofiados comprimiriam a vasculatura do tecido reduzindo a chegada de oxigênio. Em conseqüência à hipóxia, haveria um estímulo à produção de citocinas pró-inflamatórias a fim de aumentar a angiogênese e o fluxo sangüíneo.
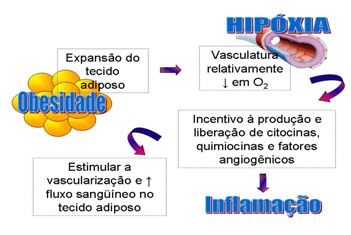
Figura 1. Mecanismo proposto para indução da inflamação a partir da hipóxia sofrida pela expansão do tecido adiposo na obesidade
Fontana et al. (200715) determinaram a concentração de adipocinas inflamatórias por meio de amostras de sangue da veia porta e da artéria radial de 25 indivíduos, de ambos os sexos, com obesidade mórbida. Os autores encontraram diferenças significantes para IL-6 e leptina (p=0,007 e p=0,002; respectivamente), sendo a concentração de IL-6 50% maior na veia porta e a de leptina 20% menor em relação à artéria radial. Mostraram também a correlação positiva (r=0,544) e significante (p=0,005) entre IL-6 e PCR, comprovando que o tecido visceral é o principal responsável por promover a inflamação sistêmica por liberar maior quantidade de citocinas pró-inflamatórias diretamente na circulação portal.
Sbarbati et al. (200616), avaliaram crianças obesas no estágio pré-puberal, que ainda não apresentavam as conseqüências metabólicas do sobrepeso, visto que dados de crianças obesas não estavam disponíveis. Os autores objetivaram avaliar o envolvimento inflamatório de tecido adiposo em crianças e identificar o potencial inflamatório da lesão elementar. Foi realizado um estudo do tipo caso-controle, sendo 19 crianças obesas e como controle, 5 crianças não obesas, de ambos os sexos. Por análise ultramicroscópica verificaram que os adipócitos das crianças obesas eram duas vezes maior que os adipócitos das não obesas. Além disso, essa análise indicou inflamação no tecido adiposo de todas as crianças obesas, não sendo encontrada nas não obesas.
Diante disso, percebe-se que a hipóxia causada pela hipertrofia tecidual é o mecanismo inicial de estímulo à produção de citocinas pró-inflamatórias e que a inflamação progride com a expansão do tecido adiposo, especialmente, o visceral.
Relação entre inflamação e obesidade
Segundo Hermsdorff & Monteiro (200412), as adipocinas atuam em diferentes tecidos e nos próprios adipócitos modulando o comportamento destes e daqueles por mecanismos de feedback.
Está claro pela presente revisão que a obesidade leva à inflamação por estimular a expressão e secreção de adipocinas pró-inflamatórias pelo tecido adiposo, mas a relação inversa, ou seja, inflamação levando o aumento do peso e obesidade tem sido sugerida por alguns autores 22, 37 (Figura 2).
Das (200122) levanta os seguintes questionamentos “Qual é o gatilho da inflamação?” e “A inflamação é causa ou efeito da obesidade?”. Da mesma forma, Engström et al. (200337) afirmaram ser razoável perguntar quem vem primeiro: a inflamação, a obesidade ou a resistência à insulina. Segundo esses autores, algumas citocinas inflamatórias como IL-6, IL-1β e TNF-α, estão envolvidas na regulação do metabolismo e da ingestão alimentar. Os mesmos realizaram uma pequena revisão e verificaram que TNF-α regula a ação da insulina no tecido adiposo, que TNF-α e IL-1β modulam a liberação de leptina por este tecido e que um polimorfismo no gene receptor-2 do TNF-α está associado com a resistência a leptina e obesidade. Além disso, encontraram um possível mecanismo de ativação do eixo hipotálamo-pituitária-adrenal que levaria a uma hipercotisolemia e ativação simpática, sendo estes associados à obesidade central, resistência à leptina e aumento na ingestão de alimentos.
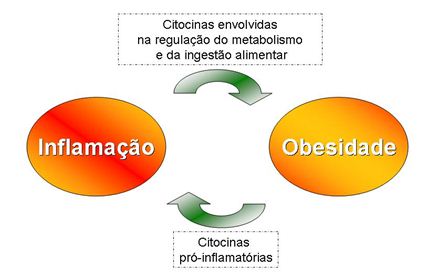
Figura 2. Ciclo vicioso entre inflamação e obesidade. Citocinas estão envolvidas no desenvolvimento da obesidade
ao passo que, a hipertrofia dos adipócitos estimula a liberação de citocinas indutoras do processo inflamatório
Assim, Engström et al. (200337) objetivaram verificar se as proteínas plasmáticas sensíveis à inflamação (PPSI) poderiam predizer o ganho de peso futuro. Para tanto acompanharam 2821 homens não diabéticos, com idade entre 38 e 50 anos por um período de 6 anos. Verificaram que a proporção de indivíduos com maior ganho de peso aumentou de 21% entre os que não expressaram PPSI para 28,3% entre os que expressaram 3 ou mais PPSI, sendo essa diferença estatisticamente significante (p<0,0005). Os autores concluíram que elevados níveis de PPSI predizem o ganho de peso em homens de meia idade.
Um dos achados de Vendrell et al. (200438) ao avaliar a interação entre resistina, adiponectina, grelina, leptina e citocinas pró-inflamatórias em indivíduos com obesidade mórbida e não mórbida, foi que os receptores de TNF-α estiveram envolvidos no sistema endócrino regulador da adiposidade corporal associado com leptina e resistina em obesos não mórbidos.
Pausova et al. (200039) se propuseram a investigar se o locus do gene TNF-α está envolvido na determinação da obesidade e da hipertensão associada à obesidade em indivíduos de origem Franco-Canadense. Os autores sugerem que o locus do gene TNF-α contribui para o desenvolvimento da obesidade e da hipertensão associada à obesidade em indivíduos hipertensos com obesidade não mórbida.
Sabe-se que os adipócitos expressam e secretam componentes do SRA e, segundo Galletti & Strazzullo (200740) uma variabilidade genética no SRA estão envolvidos na susceptibilidade ao sobrepeso e obesidade.
Diante desta revisão, percebe-se maior participação do tecido adiposo visceral na indução da inflamação e da obesidade por liberar citocinas envolvidas no processo de regulação do metabolismo e ingestão alimentar, contribuindo para a expansão do tecido adiposo que, por sua vez, gera a hipóxia, responsável pelo estímulo de citocinas pró-inflamatórias. Assim, acredita-se haver, um ciclo vicioso entre obesidade e inflamação induzidas por alteração no tecido adiposo.
Adipocinas
Algumas das adipocinas mais citadas estão listadas na Tabela 1.
Sabe-se que há diferenciação na expressão e secreção dessas adipocinas de acordo com o compartimento do tecido adiposo, ou seja, a localização dos adipócitos influencia sua característica metabólica. Em geral, o tecido adiposo visceral é conhecido como mais metabolicamente ativo por liberar ácidos graxos livres (AGL) e adipocinas pró-inflamatórias diretamente na veia porta12,13,15,9.
Tabela 1. Efeito das adipocinas no processo inflamatório

TNF-α : fator de necrose tumoral-alfa; IL-6: interleucina-6; PCR: proteína-C reativa; PAI-1: inibidor do plasminogênio ativado-1;
SRA: fatores envolvidos no sistema renina angiotensina; (+): adipocinas pró-inflamatórias; (-): adipocina anti-inflamatória.
TNF-α
É uma adipocina pró-inflamatória cuja secreção é diretamente proporcional ao tamanho dos adipócitos12,17. Secretada pelo tecido adiposo, atua nos adipócitos favorecendo a lipólise e inibindo a lipogênese, estando envolvida na regulação dos estoques de energia. Está associada ao aumento da produção de PAI-1, IL-6 e PCR12. Além disso, ativa a transcrição do fator nuclear-κβ (NFκβ), envolvido na resistência à insulina, metabolismo lipídico e apoptose18. O NFκβ também é responsável por aumentar migração de monócitos, a conversão em macrófagos e conseqüente aumento de citocinas pró-inflamatórias, bem como a expressão de moléculas de adesão endotelial12,17, além de contribuir com a redução do óxido nítrico (NO), um dos mais potentes vasodilatores do organismo humano, favorecendo a disfunção endotelial 17. Em 1999, Cerami et al.19 não apenas demonstraram que TNF-α encontra-se em níveis elevados na obesidade como também o papel central dessa adipocina no desenvolvimento das desordens metabólicas associadas à obesidade.
IL-6
A secreção da IL-6 encontra-se aumentada em indivíduos obesos. Essa adipocina pró-inflamatória estimula a liberação de ácidos graxos livres (AGL) bem como a produção hepática da PCR13. Supõe-se que seu aumento provoque uma supressão da leptina e redução da expressão IRS-1 (receptor de insulina) e GLUT-4 no fígado e músculo12. Rexrode et al. (200320) verificaram que diferentes medidas de adiposidade de um grupo de mulheres poderiam predizer níveis de IL-6 e PCR. Segundo os autores, tanto medidas de adiposidade total quanto abdominal estiveram fortemente associadas ao aumento significante dos níveis de IL-6 e PCR. Das medidas estudadas, o IMC foi o mais forte preditor da elevação desses marcadores inflamatórios.
Resistina
Adipocina envolvida no processo inflamatório promove a resistência insulínica, aumenta a produção de endotelina-1 (ET-1) - potente vasoconstritor e MCP-1, além de estimular a transcrição do NFκβ levando à disfunção endotelial13. Reilly et al. (200521) observaram se os níveis séricos de resistina estavam associados com marcadores inflamatórios, parâmetros metabólicos e aterosclerose. Os autores apresentaram que a resistina plasmática esteve altamente correlacionada com diversos marcadores inflamatórios, dentre eles IL-6, PCR, ICAM-1 e que é preditiva da aterosclerose em humanos. Segundo os mesmos, a resistina pode ser um elo entre sinais metabólicos, inflamação e aterosclerose.
PCR
Proteína de fase aguda que indica inflamação sistêmica e tem o fígado como local mais importante de sua produção, sendo sua expressão regulada por muitas citocinas inflamatórias, principalmente pela IL-6. Está diretamente relacionada ao processo aterogênico por induzir a disfunção endotelial, constituindo um importante preditor das doenças cardiovasculares (DCVs)22, 17, 23. Brasil et al., (200723) estudando crianças e adolescentes com e sem obesidade, observaram que os níveis de PCR aumentaram à medida que o IMC se elevou. Demonstrando que as concentrações de PCR foram significativamente maiores nos obesos em relação ao controle. Em conformidade com esse estudo, Sasaki et al. (200724) estudando mulheres idosas, apontaram que a adiposidade abdominal é preditor de níveis elevados de PCR nessa população.
PAI-1
Inibidor da ativação do plasminogênio é uma proteína de fase aguda que favorece a formação de trombos por inibir a formação de plasmina e, conseqüentemente, inibição da fibrinólise e a ruptura de placas de ateroma instáveis 25,17. Rega et al. (200526) investigaram se citocinas pró-inflamatórias como IL-6 e Oncostatina M (OSM) afetam a expressão do PAI-1 pelos adipócitos. Os autores estabeleceram um link entre tais mediadores inflamatórios e a expressão de PAI-1 no tecido adiposo humano e sugeriram que IL-6 e OSM estimulam a expressão de PAI-1, aumentando o risco cardiovascular em indivíduos obesos.
Leptina
Hormônio de 16 kDa produzido exclusivamente pelas células adiposas, a leptina é produto do gene da obesidade ob, sendo encontrada tanto na circulação quanto no fluido cerebroespinhal35, 34, 27. Sua expressão e secreção são diretamente proporcionais ao tamanho dos adipócitos. A leptina, vista como um link endócrino entre o tecido adiposo e o hipotálamo7, funciona como um lipostato - controla o volume do tecido adiposo e o peso corporal por inibir a ingestão alimentar e aumentar o gasto energético22, 12, 28. Entretanto uma falha nesse mecanismo poderá levar ao excesso de estoque de gordura e obesidade28.
Após sua produção, a leptina é transportada por proteínas até o cérebro onde atua no centro da fome e da saciedade, o hipotálamo. Nesse local, age estimulando neuropeptídeos anorexígenos e inibindo os orexígenos, como por exemplo, o neuropeptídeo Y, o que possibilita o controle do peso corporal28.
A expressão e secreção de leptina é diretamente proporcional ao tamanho e a localização dos adipócitos, sendo sua produção maior no tecido adiposo subcutâneo do que no visceral, além de sua produção ser maior nas mulheres do que nos homens devido às diferenças no percentual de gordura e hormonal 36, 28, 27.
Um possível mecanismo para entender a obesidade poderia ser a falha na produção e/ ou secreção da leptina pelo tecido adiposo, causando a obesidade por sua deficiência. Entretanto, sabe-se que a obesidade não é resultado da deficiência, mas da hiperleptinemia28. O que impede a leptina de controlar adequadamente o armazenamento de gordura e o peso corporal é uma falha na sinalização da leptina no hipotálamo, ou seja, uma resistência à leptina causada, possivelmente, por um problema em seu transportador ou na cascata de reações celulares28, 27.
Segundo Mantzoros (199936) ainda não se conhece a freqüência de mutações ocorridas no receptor de leptina na população em geral, entretanto, acredita-se ser muito baixa. Para Mantzoros (199936) a elucidação de mecanismos que levam à resistência a leptina possibilitaria tratamentos mais efetivos para tal morbidade por favorecer o esclarecimento de sua patogênese.
Além de lipostato, a leptina é uma adipocina envolvida também no processo inflamatório. Como adipocina pró-inflamatória atua estimulando a síntese de ET-1, no acúmulo de radicais livres nas células endoteliais, na produção de TNF-α e IL-6, na promoção da migração de monócitos e moléculas de adesão endotelial, além do aumento da agregação plaquetária17, 27. Em estudo recente29 foi demonstrado que a obesidade abdominal está associada ao desequilíbrio plasmático de leptina e adiponectina, apresentando a leptina, correlação positiva e significante com a circunferência da cintura. Os mesmos indivíduos estudados apresentaram menor relaxamento do endotélio em resposta à acetilcolina e maior contratilidade em resposta a angiotensina II.
SRA
Segundo Hermesdorff & Monteiro (200412) há evidências de que o sistema renina angiotensina (SRA) esteja envolvido na obesidade, no processo inflamatório e aterogênico. Um dos mecanismos patogênicos propostos parte da capacidade do tecido adiposo expressar e secretar angiotensinogênio, precursor de um dos maiores vasoconstritores pró-aterogênicos, a Angiotensina II (ANG II). A ANG II ativa o NFκβ que estimula a produção de moléculas de adesão endotelial dentre elas ICAM-1, VCAM-1, MCP-1 e M-CSF. Além disso, é capaz de aumentar a produção de radicais livres de NO, diminuir sua disponibilidade e facilitar a vasoconstrição, podendo ser um elo entre obesidade e hipertensão12, 6, 17. Gonzalez et al. (200730) estudaram a possível participação do SRA na inflamação microvascular induzida pela hipóxia vascular. Os mesmos sugerem que a hipóxia estimularia células localizadas em regiões distantes e estas liberariam uma substância intermediária que é transportada pela circulação. Os resultados deste estudo sugerem que o agente intermediário ativa mastócitos, e que estes, por sua vez, estimulam o SRA com conseqüente formação de ANG II levando à inflamação.
Adiponectina
Segundo Andersson et al. (200818) os adipócitos não apenas expressam e secretam adipocinas que levam ao processo inflamatório, mas também são capazes de induzir o processo anti-inflamatório pela secreção da adiponectina. Das adipocinas citadas é a única que tem ação é anti-inflamatória e anti-anterogênica, assumindo papel protetor das doenças cardiovasculares. A adiponectina, também conhecida como Acrp 30 ou Adip Q, diferentemente das citocinas pró-inflamatórias, tem sua concentração sérica reduzida com o aumento do tecido adiposo. Sua expressão e secreção é inversamente proporcional ao acúmulo de tecido adiposo visceral, é negativamente regulada por glicocorticóides e TNF-α e positivamente pela insulina12, 19, 31.
A adiponectina atua nos músculos, fígado e parede vascular. Aumenta a taxa de oxidação dos AGL, aumenta a sensibilidade à insulina e a captação de glicose, além de diminuir a liberação hepática de glicose12.
Segundo Berg & Scherer (20056) o papel anti-aterogênico da adiponectina ainda não está bem elucidado. Alguns autores relatam que a propriedade anti-aterogênica da adiponectina se dá pela supressão da resposta inflamatória endotelial por diminuir a expressão de moléculas de adesão reduzindo, assim, a aderência de monócitos à parede do endotélio, a quimiotaxia a macrófagos e sua transformação em células espumosas12, 17. Nakamura et al. (200832) objetivaram verificar se diferença na dieta e em outros fatores do estilo de vida poderiam explicar as altas concentrações séricas de adiponectina em japoneses que vivem no Japão comparados com japoneses com estilo de vida ocidental que vivem no Havaí. Eles encontraram que as maiores concentrações de adiponectina nos japoneses que vivem no Japão em relação aos que vivem no Havaí, devem-se às grandes diferenças de IMC. As diferenças de nutrientes nas populações estudadas estiveram modestamente associadas com diferenças de adiponectina.
Redução de peso e dos marcadores inflamatórios
Assim como um aumento no volume do tecido adiposo induz ao aumento da expressão de marcadores inflamatórios, um processo reverso tem sido mencionado. Segundo alguns autores25, 6, 8 uma redução no peso corporal está diretamente relacionada à redução nos marcadores inflamatórios, independente da forma como o peso foi perdido.
Borges et al. (200733) objetivaram avaliar o impacto do tratamento da obesidade nas adipocinas e no estado inflamatório em pacientes hipertensas com obesidade central. Durante um período de 16 semanas, foram avaliadas 24 mulheres hipertensas, com idade entre 18 e 65 anos. Os autores verificaram que uma redução no peso superior a 5% provocou uma redução nos marcadores, melhorando o perfil inflamatório, além de diminuir a resistência insulínica, mostrando uma correlação inversa e significante entre níveis de PCR e sensibilidade à insulina.
Considerações finais
O tecido adiposo é um importante órgão endócrino capaz de modular processos metabólicos tanto localmente como em diversos outros tecidos, tendo papel modulador da obesidade. Sua função como regulador do processo inflamatório tem sido bastante evidenciada. Um mecanismo proposto para sinalizar o início desse processo é a hipóxia do tecido causada pela expansão dos adipócitos. Dos componentes do tecido adiposo, o visceral é o mais metabolicamente ativo e mais associado à inflamação. Alguns estudiosos, entretanto, têm apontado um possível mecanismo inverso, ou seja, indução da obesidade a partir de citocinas pró-inflamatórias participantes da regulação da ingestão alimentar, o que indica um ciclo vicioso entre inflamação e obesidade.
Mais estudos precisam ser realizados a fim de elucidar a complexa interação entre adipocinas e inflamação, bem como obesidade e suas complicações.
Ainda há muitos mecanismos a serem esclarecidos, já que as informações obtidas até então, indicam ser apenas a ponta de um “iceberg”. A compreensão minuciosa das funções endócrinas e inflamatórias do tecido adiposo possibilitará não apenas um tratamento mais eficaz como também a prevenção da obesidade e suas conseqüências.
Referências bibliográficas
-
World Health Organization (WHO). Fact sheet: obesity and overweight. 2003.Internet: http://www.who.int/dietphysicalactivity/publications/facts/obesity/en/ Acesso em: 18 de outubro de 2008.
-
IBGE, 2004. Pesquisa de Orçamentos Familiares - POF 2002-2003. http://www.ibge.gov.br/home/presidencia/noticias/noticia_impressao.php?id_noticia=278. Acesso em: 18 de outubro de 2008.
-
Trayhurn P, Wood IS. Adipokines: inflammation and the pleiotropic role of white adipose tissue. British Journal of Nutrition 2004; 92:347–355.
-
Greenberg AS, Martin SO, Obesity and the role of adipose tissue in inflammation and Metabolism. Am J Clin Nutr 2006; 83(suppl):461S–5S.
-
Goossens GH. The role of adipose tissue dysfunction in the pathogenesis of obesity-related insulin resistance. Physiology & Behavior 2008; 94:206–218.
-
Berg AH, Scherer PE. Adipose Tissue, Inflammation, and Cardiovascular Disease. Circ. Res. 2005; 96:939-949.
-
Trayhurn P, Bing C, Wood IS. Adipose Tissue and Adipokines—Energy Regulation from the Human Perspective. J. Nutr. 2006; 136: 1935S–1939S.
-
Hajer GR, Van Haeften TW, Visseren FLJ. Adipose tissue dysfunction in obesity, diabetes, and vascular diseases. European Heart Journal 2008; 1-13.
-
Bays HE, González-Campoy JM, Bray GA, Kitabchi AE, Bergman DA, Schorr AB, Rodbard HW, Henry RR. Pathogenic potential of adipose tissue and metabolic consequences of adipocyte visceral adiposity. Expert Rev. Cardiovas. Ther. 2008; 6(3): 343-368.
-
Weisberg SP, McCann D, Desai M, Rosenbaum M, Leibel RL, Ferrante Jr AW. Obesity is associated with macrophage accumulation in adipose tissue. J. Clin. Invest. 2003; 112:1796–1808.
-
Ye J, Gao Z, Yin J, He Q. Hypoxia is a potential risk factor for chronic inflammation and adiponectin reduction in adipose tissue of ob/ob and dietary obese mice. Am J Physiol Endocrinol Metab 2007; 293: E1118–E1128.
-
Hermsdorff HHM, Monteiro JBR. Gordura Visceral, Subcutânea ou Intramuscular: Onde Está o Problema? Arq Bras Endocrinol Metab 2004; 48(6):803-811.
-
Fantuzzi G, Mazzone T. Adipose Tissue and Atherosclerosis: Exploring the Connection. Arterioscler. Thromb. Vasc. Biol. 2007; 27;996-1003.
-
Ribeiro Filho FF, Mariosa LS, Ferreira SRG, Zanella MT. Gordura Visceral e Síndrome Metabólica: Mais Que Uma Simples Associação. Arq Bras Endocrinol Metab 2006; 50(2): 230-238.
-
Fontana L, Eagon JC, Trujillo ME, Scherer PE, Klein S. Visceral fat adipokine secretion is associated with systemic inflammation in obese humans. Diabetes 2007; 56: 1010–1013.
-
Sbarbati A, Osculati F, Silvagni D, Benati D, Galiè M. Obesity and Inflammation: Evidence for an Elementary Lesion. Pediatrics 2006;117:220-223.
-
Lau DCW, Dhillon B, Yan H, Szmitko PE, Verma S. Adipokines: molecular links between obesity and atheroslcerosis. Am J Physiol Heart Circ Physiol 2005; 288:2031-2041.
-
Andersson CX, Gustafson B, Hammarstedt A, Hedjazifar S, Smith U. Inflamed adipose tissue, insulin resistance and vascular injury. Diabetes Metab Res Rev 2008; 24: 595–603.
-
Samad F, Uysal Kt, Wiesbrock Sm, Pandey M, Hotamisligil Gs, Loskutoff Dj. Tumor necrosis factor a is a key component in the obesity-linked elevation of plasminogen activator inhibitor 1. Proc. Natl. Acad. Sci. USA 1999, 96: 6902–6907.
-
Rexrode KM, Pradhan A, Manson JE, Buring JE, Ridker PM. Relationship of Total and Abdominal Adiposity with CRP and IL-6 in Women. Ann Epidemiol 2003;13:674–682.
-
Reilly MP, Lehrke M, Wolfe ML, Rohatgi A, Lazar MA, Rader DJ. Resistin Is an Inflammatory Marker of Atherosclerosis in Humans. Circulation 2005;111:932-939.
-
Das UN. Is Obesity an Inflammatory Condition? Nutrition 2001;17:953–966.
-
Brasil AR, Norton RC, Rossetti MB, Leão E, Mendes RP. C-reactive protein as an indicator of low intensity inflammation in children and adolescents with and without obesity. J Pediatr 2007; 83(5):477-480.
-
Sasaki JE, Krause MP, Gama MPR, Hallage T, Buzzachera CF, Santos MG, Silva SG. Influência da Adiposidade Global e da Adiposidade Abdominal nos Níveis de Proteína C-Reativa em Mulheres Idosas. Arq Bras Cardiol 2007;89(4):231-236.
-
Lyon CJ, Law RE, Hsueh WA. Adiposity, Inflammation, and Atherogenesis. Endocrinology 2003; 144:2195–2200.
-
Rega WG, Kaun C, Weiss TW, Demyanets S, Zorn G, Kastl SP, Steiner S, Seidinger D, Kopp CW, Frey M, Roehle R, Maurer G, Huber K, Wojta J. Inflammatory Cytokines Interleukin-6 and Oncostatin M Induce Plasminogen Circulation 2005;111:1938-1945.
-
Yang R, Barouch LA. Leptin Signaling and Obesity: Cardiovascular Consequences. Circ. Res. 2007;101:545-559.
-
Paracchini V, Pedotti P, Taioli E. Genetics of Leptin and Obesity: A HuGE Review. Am J Epidemiol 2005;162:101–114.
-
Rueda-Clausen CF, LaheraV, Calderón J, Bolivar IC, CastilloVR, Gutiérrez M, Carreño M, Oubiña MP, Cachofeiro V, López-Jaramillo P. The presence of abdominal obesity is associated with changes in vascular function independently of other cardiovascular risk factors. International Journal of Cardiology 2008; 1-10.
-
Gonzalez NC, Allen J, Schmidt EJ, Casillan AJ, Orth T, Wood JG. Role of the renin-angiotensin system in the systemic microvascular inflammation of alveolar hypoxia. Am J Physiol Heart Circ Physiol 2007 292: H2285–H2294.
-
Packard RRS, Libby P. Inflammation in Atherosclerosis: From Vascular Biology to Biomarker Discovery and Risk Prediction. Clinical Chemistry 2008; 54(1):24–38.
-
Nakamura Y, Ueshima H, Okuda N, Higashiyama A, Kita Y, Kadowaki T, Okamura T, Murakami Y, Okayama A, Choudhury SR, Rodriguez B, Curb JD, Stamler J. Relation of dietary and other lifestyle traits to difference in serum adiponectin concentration of Japanese in Japan and Hawaii: the INTERLIPID Study. Am J Clin Nutr 2008; 88:424 –30.
-
Borges RL, Ribeiro-Filho FF, Carvalho KMB, Zanella MT. Impacto da Perda de Peso nas Adipocitocinas, na Proteína C-Reativa e na Sensibilidade à Insulina em Mulheres Hipertensas com Obesidade Central. Arq Bras Cardiol 2007; 89(6):409-414.
-
Trayhurn P. The biology of obesity. Nutrition Society 2005; 64: 31–38.
-
Rajala MW, Scherer PE. Minireview: The Adipocyte—At the Crossroads of Energy Homeostasis, Inflammation, and Atherosclerosis. Endocrinology 2003; 144: 3765–3773.
-
Mantzoros CS. The Role of Leptin in Human Obesity and Disease: A Review of Current Evidence. Ann Intern Med. 1999;130:671-680.
-
Engström G, Hedblad B, Stavenow L, Lind P, Janzon L, Lindgärde F. Inflammation-Sensitive Plasma Proteins Are Associated With Future Weight Gain. Diabetes 2003; 52:2097–2101.
-
Vendrell J, Broch M, Vilarrasa N, Molina A, Gómez JM, Gutiérrez C, Simón I, Soler J, Richart C. Resistin, Adiponectin, Ghrelin, Leptin, and Proinflammatory Cytokines: Relationships in Obesity. Obes Res. 2004;12:962–971.
-
Pausova Z, Deslauriers B, Gaudet D, Tremblay J, Kotchen TA, Larochelle P, Cowley AW, Hamet P. Role of Tumor Necrosis Factor-a Gene Locus in Obesity and Obesity-Associated Hypertension in French Canadians. Hypertension. 2000;36:14-19.
-
Galletti F, Strazzullo P. Involvement of the renin-angiotensin system in obesity: Older and newer pathways. Nutrition, Metabolism & Cardiovascular Diseases 2007; 17:699-704.
Outros artigos em Portugués
 |

Búsqueda personalizada
|
|---|---|
|
EFDeportes.com, Revista
Digital · Año 15 · N° 150 | Buenos Aires,
Noviembre de 2010 |
|