
|
|||
|---|---|---|---|
|
|
Analise da célula inflamatória (macrófago), em uma lesão músculo esquelética sob crioterapia. Estudo em grupos controle e não controle Análisis de la célula inflamatorias (macrófagos) en una lesión músculo esquelética bajo crioterapia. Estudio en grupos control y no control |
|
|
|
*Doutorado em Oceanografia Biologica **Especialista em Fisioterapia em Geriatria (Brasil) |
Maria Paula Melitto da Silveira* Renato Claudino** |
|
|
|
Resumo A aplicação do gelo insere-se amplamente nos protocolos de tratamento de diversas patologias. Quando aplicada desencadeia efeitos nos vários sistemas e órgãos. Porém há contradições sobre o tempo de aplicação da crio terapia na fase aguda de lesão muscular, e seus possíveis efeitos na reparação deste tecido, uma vez que há poucos estudos científicos que indiquem a crioterapia no processo inflamatório agudo. O objetivo deste estudo experimental teve o propósito de comparar uma célula inflamatória (neutrófilo) de forma quantitativa, em 0h, 3h, 6h, 9h, 12h, 24h e 48h de tratamento com crioterapia após lesão tecidual. Assim, foram utilizados 42 ratos distribuídos aleatoriamente em dois grupos (controle e tratado), sendo subdivididos em sete grupos de três animais para cada hora pré-determinada. Foi realizada uma lesão per furo na pata traseira esquerda dos animais, tanto do grupo controle quanto o grupo tratado. Após a lesão, foi aplicada criomassagem por um período de 7 minutos, nas horas acima citadas, nos grupos tratados. O grupo controle não recebeu a técnica de criomassagem. O resultado encontrado nos achados histológicos evidenciou-se que o grupo submetido à técnica de criomassagem, apresentou significativa redução dos neutrófilos durante as 48 horas de tratamento. Podemos concluir com este trabalho, que a crioterapia aplicada na inflamação aguda do músculo esquelético, minimiza a presença de neutrófilos na área lesionada. Unitermos: Inflamação aguda. Músculo esquelético. Crioterapia |
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 14 - Nº 136 - Septiembre de 2009 |
|
|
1 / 1
Introdução
As lesões musculares isoladas em indivíduos saudáveis raramente são fatais, elas são importantes porque causam muita dor e sofrimento físico. A primeira resposta do organismo a esta lesão é o desenvolvimento de um processo inflamatório, com o objetivo de livrar o organismo tanto da causa inicial da agressão celular, quanto do dano causado por esta agressão. As manifestações clínicas da inflamação aguda são: dor, calor, rubor e perda da função (SALTER, 2001).
Segundo PEREIRA (1998), a inflamação é uma reação dos tecidos vascularizados a um agente agressor, caracterizada pela saída de líquidos e de células do sangue para o interstício. Pode ser induzida por trauma físico e químico ou pela ativação da imunidade.
Os tecidos danificados produzem inflamação, e em alguns casos, gera uma situação auto perpetuadora a menos que algum processo limitado comece a agir no local (SHADFORTH, 2001).
Sendo assim, a inflamação tem como objetivo defender a área lesionada contra substâncias estranhas, removendo o tecido morto ou necrosado de modo que, a cicatriz possa acontecer e promover a regeneração normal (ROSA et al, 2002).
Um trauma agudo pode ocasionar lesões de ligamentos, músculos, vasos e nervos e, conseqüentemente, a presença de hemorragia, edema, dor e espasmo muscular protetor (RODRIGUES, 1995; SIZINIO, 2003).
A reação inicial envolve hemorragia e perda de fluido devido ao rompimento de vasos, em seguida, vasoconstrição com fechamento de vasos e coagulação sangüínea para prevenir perda adicional de sangue (PEREIRA, 1998; ESPERANÇA & NETO, 2001; KITCHEN & BAZIN, 2003).
O local agredido apresenta aumento no metabolismo e vasodilatação, pois os tecidos traumatizados têm sua necessidade metabólica aumentada, o que produz aumento no consumo de oxigênio, resultando em hipoxia secundária. O fluxo sangüíneo cessa distalmente á lesão pelo mecanismo de fechamento e devido à estase sangüínea. As células sem oxigênio utilizam o seu próprio metabolismo anaeróbico de curta duração (KNIGHT, 2000).
O dano celular promove a liberação de histamina, bradicinina e outras substâncias químicas cuja tarefa é avisar o restante do corpo que as células foram danificadas e mobilizar recursos do organismo para lidar com esta situação. Estas substâncias químicas modificam e regulam o restante da resposta inflamatória, tentando neutralizar a causa da lesão, e começar a remover os detritos celulares (KNIGHT, 2000).
Os mecanismos celulares são ativados para impedir que bactérias e outros corpos estranhos penetrem no local possibilitando a retirada de resíduos dos tecidos destruindo antes do reparo, impedindo qualquer infecção invasora (LEDERMAN, 2001; KITCHEN & BAZIN, 2003).
Agentes lesivos atingem os tecidos provocando uma resposta local para adaptar os tecidos à nova situação, favorecendo a eliminação da agressão ou de seus efeitos. Essa resposta se faz pela liberação de mediadores que induzem modificações do micro circulação e migração de fagócitos para interstício (TORRES & NORONHA, 2004).
A histamina liberada após dano tecidual produz vaso dilatação, acarretando um aumento drástico no fluxo sangüíneo. O efeito global desse processo é o surgimento e a manutenção de grandes quantidades de líquido edematoso (ANDREWS, 2000).
Os neutrófilos são as primeiras células a chegarem ao local da lesão, penetrando no tecido, e imediatamente começam a fagocitose através de seus pseudópodes, englobando a partícula estranha, entretanto possuem um tempo de vida curto, e morrem no local da inflamação formando pus (PARHAM, 2001; GUYTON & HALL, 2002; KITCHEN & BAZIN, 2003).
A infiltração de neutrófilos libera grande quantidade de proteases e colágenas; iniciando também a lise de proteínas celulares e colágenas. Além desses mediadores, os radicais livres e gelatinase são liberados acentuando o dano tecidual (TROWBRIDGE & EMLING, 1998; KITCHEN & BAZIN, 2003).
Os neutrófilos em comparação aos macrófagos são mais abundantes no tecido lesado, apresentam grânulos no citoplasma, e não estão normalmente presentes nos tecidos saudáveis, porém estão presentes em grandes quantidades no sangue circulante (JANCAR, 2001; PARHAM, 2001; GUYTON & HALL, 2002; ABBAS ET AL, 2003).
Metodologia
O presente trabalho foi desenvolvido no Laboratório de Fisiologia do Centro de Ciências da Saúde da Universidade do Vale do Itajaí - UNIVALI, na cidade de Itajaí, Santa Catarina. A amostra foi constituída de 42 ratos machos (Ratos norvegicus albinus), da linhagem Wistar, com peso corpóreo variando entre 180 a 200gramas, procedentes do Biotério da Universidade do Vale do Itajaí – UNIVALI, SC.
Os animais foram confinados em gaiolas com assoalho recoberto de serragem, com dieta livre do tipo ração sólida e água à vontade, em sala com temperatura ambiente, ciclo dia-noite natural. Para realização do experimento os animais foram divididos aleatoriamente em dois grupos: Grupo Tratado e o Grupo Controle. Cada grupo perfazendo um total de 21 animais, que foram subdivididos em sete subgrupos. Cada subgrupo com três animais.
Os subgrupos foram classificados respectivamente por tempo de lesão e aplicação da crioterapia, ou seja, o grupo I tratado foi lesionado, aplicado crioterapia e sacrificado na hora zero, já o grupo II tratado foi lesionado na hora zero e aplicado, três horas depois foi aplicado novamente e sacrificado, o grupo III tratado, foi lesionado na hora zero, aplicado, após três horas foi aplicado novamente e após mais três horas foi aplicado e sacrificado, e assim foi realizado até o grupo VII tratado. O grupo controle seguiu os mesmos critérios do grupo tratado, porém sem aplicação. Todos os animais foram anestesiados com éter etílico e submetidos à tricotomia da pata traseira esquerda, região correspondente ao músculo seguiu então de anti-sepsia com álcool iodado 70%, e assim o uso de um objeto perfuro-cortante, o qual apresentava 2,7 mm de diâmetro na base e 0,9 mm de diâmetro no ápice. O comprimento delimitado da lesão foi de 4 mm. O tratamento foi realizado após a lesão muscular, nos intervalos de tempo determinado para cada subgrupo do grupo tratado em 0h, 3h, 6h, 9h, 12h, 24h e 48h de tratamento com crioterapia após lesão tecidual e grupo controle.
Assim para microscopia e análises foram efetuadas em microscópio óptico, sendo realizada a contagem de neutrófilos em três campos aleatoriamente escolhidos em cada lâmina. Os resultados foram comparados entre o grupo de animais controle e o grupo de animais tratados, e analisados através do teste t para os números de células encontradas.
Resultados
Os macrófagos foram considerados células com núcleos ovóides, com citoplasma claro e superfície irregular. Quanto às células gigantes, visto que a mesma envolve a fusão de muitos macrófagos, foram consideradas aquelas com tamanho evidentemente maior e que possuíam diversos núcleos.
Considerando a contagem de neutrófilos através do teste t, foi possível verificar diferenças significativas para p<0,05, nos horários mostrados na tabela.
Tabela 1. Médias do número de neutrófilos nos vários momentos de coleta; seus desvios padrões;
t e p obtidos nos teste t, e variações a menor no número de células após aplicação de crioterapia.
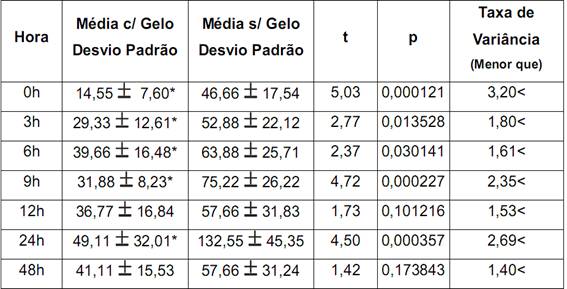
Houve uma redução considerável de neutrófilos nos animais tratados em relação aos animais controle. Sendo que esta redução se manteve em todos os períodos de aplicação.
Discussão
Segundo KNIGHT (2000), o tempo de aplicação da crioterapia, para promover efeito significativo na inflamação aguda, deve ser de aproximadamente 30 minutos.
Para as áreas de grandes massas musculares deve-se aplicar por 40 minutos, a cada duas horas. Recomenda também que a aplicação seja realizada num período de 12 a 72 horas, ou até que a tendência ao edema tenha desaparecido.
O tempo de aplicação utilizado para realização deste trabalho foi de 7 minutos, conforme (STAMFORD, 1996), por um período de 48 horas, com intervalo de 3 horas a cada aplicação. Em relação à periodicidade, este é um dado não muito claro na literatura.
Porém, os resultados microscópicos obtidos, mostraram que o intervalo de três horas para cada aplicação, foi suficiente para reduzir a intensidade da resposta inflamatória aguda.
De acordo com os dados obtidos, pode-se comprovar estatisticamente que houve redução significativa no número de células inflamatório (neutrófilos) mediante a aplicação de crio terapia. Embora qualitativamente, também se pode observar a redução circulatória na área lesada mediante aplicação de crioterapia.
Conclusão
De acordo com os dados obtidos, podem-se evidenciar os efeitos da crioterapia no controle de um dos eventos da resposta inflamatória aguda. Embora haja pouquíssimas evidências na literatura a respeito da atuação da crioterapia nos eventos celulares do processo inflamatório agudo, os dados comprovam a redução do número de células inflamatórias. Assim, com a redução do processo inflamatório, a cicatrização inicia mais rapidamente, e conseqüentemente uma diminuição do tempo total de cicatrização.
Estes dados são de fundamental importância para os Fisioterapeutas, pois dessa forma, ficou comprovado que a crio terapia atua diretamente na redução da resposta inflamatória, diminuindo o influxo de neutrófilos na área lesionada, podendo então ser optada como recurso de tratamento para auxiliar no processo de recuperação de lesões musculares.
Para tanto, seria indicado um experimento que comprovasse o efeito da crioterapia no tempo total de reparação tecidual após uma lesão, necessitando para isto, um procedimento experimental de maior duração.
Referencias bibliográficas
-
ABBAS, K, A; LICHTMAN, H, A; POBER, S, J. Imunologia Celular e Molecular. Rio de Janeiro: Revinter, 2003. p. 283-301.
-
ANDREWS, J. R.; HARRELSON, G. L.; WILK, K. E. Reabilitação Física das Lesões Desportivas. 2 ed. Rio de Janeiro: Guanabara Koogan, 2000.
-
ESPERANÇA, P, C, J; NETO, G, M, G, N. Patologia. Lesão e Restauração. In: FREIRE, E. Trauma. A Doença do Século. v. 1, São Paulo: Atheneu, 2001. p. 103-105.
-
GUYTON, C, A; HALL, E, J; Tratado de Fisiologia Médica. 10 ed. São Paulo: Guanabara Koogan, 2002. p. 371-375.
-
KITCHEN, S.; BAZIN, S. Eletroterapia Prática Baseada em Evidências. 11 ed. São Paulo: Manole, 2003.
-
KNIGHT, L. K. Crioterapia no Tratamento de Lesões Esportivas. São Paulo: Manole, 2000.
-
LEDERMAN, E. Fundamentos da Terapia Manual. São Paulo: Manole, 2001.
-
PARHAM, P; O Sistema Imune. Porto Alegre: Artmed, 2001. p. 14-17.
-
PEREIRA, L, E, F. Etiopatogênese Geral das Lesões. In FILHO, B, G. Patologia Geral. 2 ed. Rio de Janeiro: Guanabara Koogan, 1998. p.111.
-
PINHEIRO, F. B. Métodos de Aplicação da Crioterapia. Disponível em: http;//www.fbpfisioterapia.hpg.ig.com.br/métodos.html, acessado em 27. jun. 2002.
-
ROSA, G.; NUNES, C.; OLIVEIRA, J. Efeitos fisiológicos da crioterapia na inflamação aguda causada por traumatismo fechado-uma revisão. Reabilitar. n. 14, 2002.
-
RODRIGUES, E. M.; GUIMARAES, C. S. Manual de Recursos Fisioterapêuticos Rio de Janeiro: Revinter, 1998.
-
SALTER, B, R. Distúrbios e Lesões do Sistema Musculoesquelético. 3 ed. São Paulo: Medsi, 2001.
-
SHADFORTH, M. Imunologia, Inflamações e Resposta de Fase Aguda. In: DAVID, C; LLOYD, J. Reumatologia para Fisioterapeutas. São Paulo: Premier, 2001. p. 16-17.
-
SIZINIO, K. H; Ortopedia Princípios e Prática. Porto Alegre: Artmed, 2003.
-
TORRES, L. F. B.; NORONHA, L. Músculos esqueléticos. In BRASILEIRO, G. F.; PITTELLA, J. E. H.; BAMBIRRA, E. A.; BARBOSA, A. J. A. Bogliolo patologia. 6 ed. Rio de Janeiro: Guanabara Koogan, 2004. p. 928-947.
-
TROWBRIDGE, O, H; EMLING, C, R. Inflamação: Uma Revisão do Processo. 4 ed. São Paulo: Quintessence Publishing Inc, 1998.
Outros artigos em Portugués
 |
|
|---|---|
|
revista
digital · Año 14 · N° 136 | Buenos Aires,
Septiembre de 2009 |
|