
|
|||
|---|---|---|---|
|
|
O efeito do treinamento de força e administração do hormônio de crescimento sobre o músculo gastrocnemius Resultado del entrenamiento de la fuerza y la administración de la hormona de crecimiento en el músculo gastrocnemio Effect of the strength training and growth hormone administration in the gastrocnemius muscle |
|
|
|
*Laboratório de Microscopia Eletrônica, Instituto de Biociências, Depto. de Biologia, Unesp - Rio Claro, São Paulo **Laboratório de Morfologia Instituto de Biociências, Depto. de Biologia, Unesp - Rio Claro, São Paulo ***Laboratório de Mecanofisiologia, Faculdade Anhanguera de Bauru, Bauru, São Paulo ****Laboratório Experimental em Animal, UNAERP – Ribeirão Preto, São Paulo (Brasil) |
Runer Augusto Marson* *** Flávio Henrique Caetano* Arthur Rizzi Soares** **** Francisco Pereira Santi** |
|
|
|
Resumo O presente projeto teve como objetivo identificar as alterações ultra-estruturais do músculo gastrocnêmio, promovidas pela administração subcutânea de hormônio do crescimento. Para este estudo foram utilizados 12 ratos (Wistar). Os animais foram divididos randomicamente em 02 grupos: ratos treinados sem administração do GH (RTSH) e ratos treinados com administração do GH (RTCH). Os ratos executaram um treinamento de força durante 10 semanas. A administração subcutânea do GH foi por todo o período de treinamento de força, após os animais foram sacrificados e a secção transversa do músculo gastrocnêmio removida e preparada segundo rotina para análise de microscopia eletrônica de transmissão (MET) e os cortes foram realizados utilizando-se o Ultramicrótomo Sorvall Porter Blum MT2 e analisados no CM 100 Philips. Os resultados da administração do GH demonstraram aumento dos espaços entre as miofibrilas. Além disto, ocorreram divisões das miofibrilas, acúmulo de partículas de glicogênio e tecido conjuntivo, estas mais perceptíveis no RTCH. Assim concluiu-se que a administração do GH acompanhada de treinamento de força faz com que ocorra ativação de síntese protéica, induzindo as alterações nas dimensões e formas das miofibrilas, acúmulo de glicogênio e de colágeno entre as miofibrilas do músculo gastrocnemius. Unitermos: Treinamento de força. Ultraestrutura. Músculo esquelético.
Abstract The aim of investigation was identify the ultrastructural alterations of gastrocnemius muscle submitted the growth hormone (GH) subcutaneous administration. For this study were used 12 rats (wistar). The animals were divided in 02 groups: rats trained without administration of GH (RTSH) and rats trained with administration of GH (RTCH). The rats executed the strength training during 10 weeks. The subcutaneous administration of the GH was for all period of strength training, after the animals was sacrificed and the crossection of the gastrocnemius muscle removed and prepared for analysis of transmission electronic microscopy (MET) and the cuts was carried through using the Sorvall Porter Blum MT2 ultramicrotomy and analyzed in the CM100 Philips. The results of the administration of the GH had demonstrated an increase thickness space of myofibril. Were identified myofibrils divisions, accumulation of glycogen particles and tissue conjunctive (perceivable in the RTCH). The administration of the followed GH of strength training promoved the increase of protein synthesis, inducing the alterations in the dimensions and myofibrils forms, accumulation of glycogen and collagen among gastrocnemius myofibrils. Keyswords: Strength training. Ultrastructure. Skeletal muscle |
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 14 - Nº 136 - Septiembre de 2009 |
|
|
1 / 1
Introdução
O hormônio do crescimento, mais conhecido como GH (Growth Hormone), que algumas vezes é denominado de somatotrofina, é produzido na porção anterior da glândula adeno-hipófise. Este hormônio promove o aumento da entrada de aminoácidos nas células, facilita a síntese protéica bem como o crescimento dos ossos longos. O GH inibe a ação da insulina reduzindo o uso da glicose, aumentando, assim, a síntese glicoses pelo fígado (gliconeogênise). Powers et al.¹ relata que ocorre também aumento da mobilização dos ácidos graxos dos tecido adiposo para poupar a glicose do plasma. Portanto, o GH é um liberador da somatomedina, proveniente do fígado, que exerce um papel importante no metabolismo das proteínas, gorduras e dos carboidratos, segundo Keizer e Rogol².
Pombo, et al.3 afirmam que o GH é uma molécula com 191 aminoácidos que circula pelo menos em parte, ligada a proteínas transportadoras denominadas GHBPs (GH bindings proteins), que podem modular a atividade biológica do hormônio.
Anabólicos (esteróides anabólicos e mais recentemente o GH) são usados para aumentar a performance dos atletas. Apesar de não existir uma definitiva prova dessa melhora pelo efeito dos esteróides anabólicos, evidências sugerem que eles podem aumentar a força muscular em alguns subgrupos de atletas. Infelizmente, numerosos efeitos colaterais podem ocorrer devido ao uso abusivo de esteróides. Horber4, relata que tanto atletas quanto treinadores acreditam na eficiência dos anabólicos, e testes em períodos de treinamento não são obrigatórios, o abuso destes pelo mesmos deturparão a competição honesta no esporte.
A relação entre GH e IGF em função do exercício está relacionado a intensidade do esforço principalmente em situações agudas de exercício de potência, segundo Kraemer et al.5, bem como em exercícios que requerem esforços acima de 60% do consumo de oxigênio [6]. Exercício que envolvam a máxima força de trabalho essa concentração pode aumentar em torno de vinte vezes a mais do que a concentração de repouso [7].
A concentração circulante do GH e da IGF tem um papel essencial durante o crescimento e desenvolvimento global, principalmente dos músculos, ainda que a sua concentração diminua em função da idade. Sendo assim, alguns tecidos incluindo o músculo, produzem IGF-1 para a ação autócrina e parácrina. A manipulação genética do IGF-1 tem demonstrado consideráveis efeitos anabólicos tanto em animais jovens quanto adultos. O IGF-1 existe em múltiplas isoformas e uma, a qual difere da produzida no fígado (sistêmica - IGF-1Ea), parece ser particularmente sensível a sinais mecânicos e a desgaste muscular. Essa isoforma, segundo Harridge8, é denominada de mecâno fator de crescimento (MGF - Mechano Growh Factor). As ações do IGF-1 e do MGF estimulam a síntese protéica bem como a ativação, proliferação e diferenciação das células satélite.
As propriedades anabólicas do GH vêm sendo investigadas intensamente. Os efeitos da administração deste hormônio sobre a musculatura normal, hipertrofiada e atrofiada têm sido estudada previamente em animais que têm demonstrado o aumento no peso e no tamanho muscular. Sendo assim o presente estudo teve como objetivo identificar alterações ultraestruturais do músculo gastrocnemius em ratos sobre a influência da administração do GH com um treinamento de força.
Metodologia
O presente estudo utilizou-se de doze ratos machos Wistar, machos, com aproximadamente 90 dias de idade na fase inicial do experimento. Os ratos foram mantidos no Biotério do Laboratório Experimental em Animal da Universidade de Ribeirão Preto, em gaiolas coletivas, alimentados com ração balanceada e água “ad libitum”. Durante todo período do estudo, o biotério teve controle automático de luz e temperatura controlada de 23ºC. Os animais foram distribuídos nos seguintes grupos: Rato Treinado sem Hormônio (RTSH) e Rato Treinado com Hormônio (RTCH).
Os animais dos grupos RTSH e RTCH realizaram o trabalho de adaptação ao meio liquido por um período de 01 semana. Os animais foram submetidos a um teste de carga máxima (CM), para quantificar a maior sobrecarga possível que o animal executasse apenas um salto vertical por toda a extensão do tanque, com profundidade de 35 cm de água. Os saltos foram realizados em um tubo de PVC com 25 cm de diâmetro visando limitar o animal de seguir para outra direção, favorecendo, dessa forma, o salto. Para padronização e validação do CM, foi considerada carga máxima quando o animal ultrapassou a boca para fora da superfície da água por completo. Os dados obtidos com o CM foram utilizados para prescrição e acompanhamento do treinamento.
No treinamento de força os animais do grupo RTSH e RTCH foram submetidos, inicialmente, à uma adaptação ao meio líquido (31±1 ºC), para evitar um possível estresse no animal, o qual não receberá qualquer resistência externa durante a primeira semana.
Após essa semana foi feito teste de carga máxima que consistirá no incremento de cargas adicionais ao peso corporal do animal até o instante em que o animal não consiga ultrapassar o nível de água. Entre as execuções, para determinar a carga máxima, foi dado um intervalo de 5 minutos de descanso. Este teste foi realizado semanalmente até o término do treinamento.
O protocolo de treinamento constou de duas fases:
Fase Adaptação ao Treinamento
O treinamento inicial constou da execução de 3 séries de 8 saltos com intervalo entre as séries de 90 segundos. A carga utilizada para a execução dos saltos foi o equivalente a 45% (± 5%) da carga máxima. Esse treinamento visa a adaptação do animal à carga bem como ao tipo de exercício. Este foi realizado 3 vezes por semana durante 2 semanas.
Fase Treinamento
O treinamento visando o ganho de massa muscular (hipertrofia) foi administrado logo após o término da fase de adaptação com a execução de 3 séries de 8 repetições durante 8 semanas 3 vezes por semana, variando somente os percentuais de carga em relação a carga máxima. Com isso na primeira semana o treinamento teve uma sobrecarga de 70%, na segunda e terceira semana um aumento para 75%, na quarta semana 80%, na quinta e sexta semana 85% e 90% na sétima e oitava semana de treinamento.
O grupo RTCH administrou o hormônio de crescimento (GH) durante toda fase de treinamento. O GH apresentado na concentração de 4 U.I., em pó liofilizado (frasco-ampola), o qual é acompanhado por solvente bacteriostático para uso parental. A dosagem foi de 0.2UI/kg e sua administração via subcutânea, no dorso do animal, 3 vezes por semana em dias alternados e o peso corporal dos animais foram aferidos nos dias de administração do GH, para correção da dosagem.
Após o término do treinamento foi feito a sacrifício dos animais onde foi removido o músculo gastrocnemius para análises de microscopia eletrônica de transmissão (MET). Foram analisados fragmentos da seção transversa do músculo gastrocnemius os quais foram fixados em glutaraldeido 2,5% em tampão cacodilato de sódio a 0,1 M durante 2 horas. Após o término desse intervalo de tempo os fragmentos foram lavados 3 vezes por 5 minutos em tampão fosfato 0,1M e logo em seguida foram pós - fixados em tetróxido de Ósmio 1% durante 2 horas no escuro.
O material lavados em água destilada e colocados por 2 horas em uranila para que após o término desse tempo os fragmentos foram desidratados em acetona
Após a desidratação o material foi colocado em resina – acetona durante 24 horas e em seguida em resina para que, por fim, realizou-se a inclusão do mesmo.
O material foi cortado no Ultramicrótomo Sorvall Porter Blum MT2 e em seguida contrastado em acetato de uranila e citrato de chumbo. Sendo assim o material após contrastado foi analisado e fotografado ao microscópio eletrônico de transmissão CM 100 Philips.
Resultados
O experimento mostrou alterações na morfologia das estruturas da miofibrila. Quando foi observado o RTCH em relação ao RTSH demonstraram também um aumento do espaço entre as miofibrilas bem como uma divisão acentuada dos sarcômeros da miofibrila do músculo gastrocnemius (Figura 1-A e 1-B).

Figura 1. Micrografia eletrônica da miofibrila do RTSH (A) e RTCH (B) demonstrando o aumento do espaço entre as
miofibrilas (seta), demonstrando a desorganização do sarcômero (Sc) - em abundância no RTCH. (Escala = 1,5mm).
Estas observações são melhores visualizadas na Figura 2 bem como o acúmulo de partículas de glicogênio entre as miofibrilas do RTSH e RTCH neste em maior concentração.

Figura 2. Visão ultraestrutural da miofibrila do músculo gastrocnemius de RTSH (A) e RTCH(B), aumento da espessura entre as miofibrilas (seta),
aglomerado de partículas de glicogênio (ponta da seta), divisão da miofibrila (seta dupla), ambas mais abundantes no RTCH. (Escala = 0,6mm)
Um acúmulo de tecido conjuntivo (colágeno) foi observado no RTSH (Figura 2-A) e RTCH (Figura 2-B) entre as miofibrilas do músculo gastrocnemius.
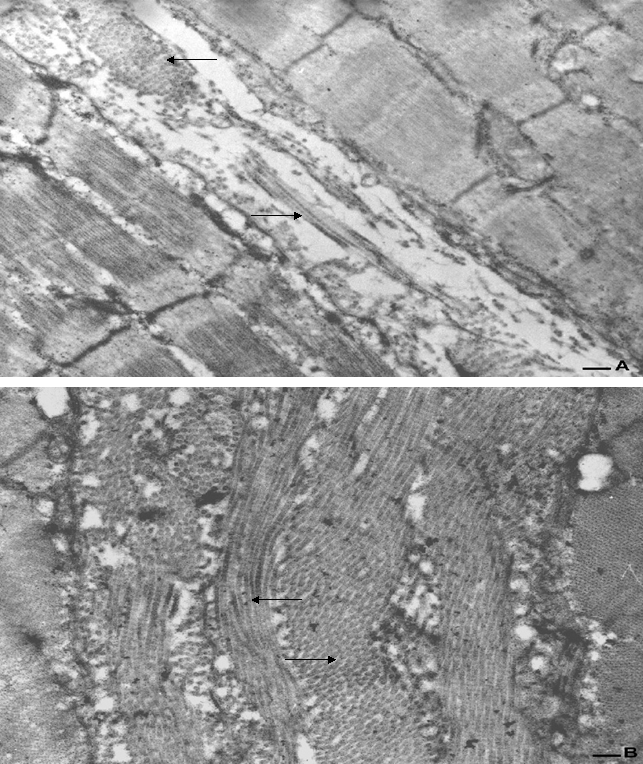
Figura 3. Micrografia eletrônica da miofibrila do RTSH (A) e RTCH (B), acúmulo de fibras de colágeno (seta) em maior abundância do RTCH. (Escala = 0,6mm).
Discussão
O hormônio do crescimento (GH) é uma molécula com 191 aminoácidos que circula pelo menos em parte, ligada a proteínas transportadoras denominadas GHBPs (GH bindings proteins), que podem modular a atividade biológica do hormônio [3]. Atletas que querem desenvolver massa muscular tem procurado vários caminhos para chegar a essa finalidade, um deles é o abuse dos esteróides anabólicos e do GH.
Salomon et al9 afirmam que GH é um hormônio anabólico capaz de aumentar a massa muscular. Esta característica foi demonstrada claramente em animais usando diferentes modelos combinando administração de GH, hipofisectomia, suspensão do membro inferior e imobilização [10 e 11]. Em humanos, Russell-Jones e Umpleby12, Marcus et al.13, Butterfield et al14 relatam que a administração promove aumento da massa corporal total e síntese protéica e inequivocadamente aumenta a massa magra e diminui a massa gorda [15, 16, 17, 18, 19, 20 e 21].
Lange et al.22 relataram que somente a administração do GH não promove um aumento da secção transversa do músculo quadríceps ou induz a hipertrofia da fibra muscular demonstrando que a somente a administração de GH tem pouco efeito sobre a hipertrofia de músculo esquelético e força.
Estas caracteríscticas fizeram com que indivíduos saudáveis e atletas utilizassem o GH para promover um aumento da massa muscular e força. Frisch23 relata que a melhora da força muscular obtida pôr um treinamento de resistência em homens saudáveis não aumentou com a administração do GH. O aumento da massa magra foi observado em indivíduos que treinaram utilizando o GH onde obviamente não foi devido ao acréscimo das proteínas contrácteis, mas propriamente pela retenção de fluídos ou pôr acúmulo de tecido conjuntivo.
Um aumento da espessura do espaço entre as miofibrilas foi observado neste estudo (Figura 1) podendo demonstrar assim o aumento da retenção de fluídos intercelulares da miofibrila do RTSH (Figura 1-A) e RTCH (Figura 2-B) notadamente nos RTCH. O mesmo aconteceu quando foi observado o acúmulo de tecido conjuntivo (colágeno) entre as miofibrilas principalmente no RTCH (Figura 3-B).
Estudos em animais sugerem que a administração de GH pode influenciar a composição da fibra muscular, mas os resultados na são uniformes. Em estudos com ratos normais foi observada a indução de hipertrofia da fibra do tipo II [24]. Demonstrando que a fibra muscular expressa o receptor IGF-1 [25], e esta evidência sugere que a fibra muscular também expresse um receptor para o GH [26].
Estudos de Friden et al.27,28 demonstram através da biópsia muscular microtraumatismo da linha Z das miofibrilas. Isto pode ser explicado pela sobrecarga muscular local. As alterações das estruturas da miofibrila, principalmente as bandas Z, ocorrem por elas serem o local mais fraco dentro do sarcômero, pois representa a menor unidade da fibra muscular. Estas divisões (microtraumatismo) das linhas Z da miofibrila também foram observadas na micrografia eletrônica nos RTCH (Figura 1-B).
Estas alterações ocorrem devido ao treinamento de força, principalmente no trabalho dinâmico negativo onde os filamentos são estendidos e até mesmo rompidos. Dos dois lados das bandas Z ocorrem movimentos opostos de tração por parte das cabeças de miosina que tentam, apesar das intensas forças externas, fazer seu trabalho de contração e encurtar o músculo e o sarcômero. As conseqüências disso são bandas Z mais largas ou rompidas [29].
Friden et al.30 relatam que nas fibras de contração rápida o grau de lesão é maior e sua recuperação mais lenta que as das fibras ST. Fato que pode vir a ser explicado por meio das bandas Z mais largas nas fibras de contração lenta que por sua vez têm uma ligação mecânica mais forte entre as unidades contráteis.
Os microtraumatismos das estruturas do tecido conjuntivo resultam em uma transformação muito alta na região mesmo [31]. De acordo com Green et al.32 o hormônio de crescimento estimula a formação de tecido por 2 mecanismos: um direto que leva a diferenciação de células precursoras e um indireto, mediado pelo aumento do IGF-I, que estimula a proliferação celular por mecanismos autócrinos e parácrinos. Segundo estes autores o GH é capaz de influenciar o metabolismo dos fibroblastos levando o aumento da síntese da matriz, incluindo os colágenos tipo I e III.
Essa relação de GH e produção de colágeno também foram observadas na micrografia eletrônica da miofibrila (Figura 3) onde é demonstrado o acúmulo de colágeno entre as miofibrilas e em maior quantidade nos RTCH (Figura 3-B).
Steenfos e Jansson33, Steenfos34 e Rasmussen et al.35, afirmam que o GH é um polipeptídio que tem papel importante na regulação da cicatrização, acelerando a formação local de tecido de granulação e o deposito de colágeno.
Os principais efeitos do GH são o aumento da síntese protéica, a diminuição da degradação de proteínas, o aumento da mobilização de lipídeos, a diminuição da oxidação de glicose e o aumento do armazenamento de glicogênio [36 e 37].
Esse acúmulo de partículas de glicogênio também foi observado nos resultados da análise de MET (Figura 1 e 2) demonstrando que há um acúmulo de partículas de glicogênio, porém mais abundante nos RTCH (Figura 1-B e Figura 2-B)
O GH pode exercer seus efeitos diretamente nas células alvo, ou suas ações podem ser mediadas através do IGF [38]. Receptores para o hormônio de crescimento foram demonstrados em diversas células, incluindo queratinócitos, fibroblastos e células endoteliais [39 e 40]. Estudos de Belcher e Ellis41 e Chrestensen et al.42 descreveram o GH como um potente anabolizante, capaz de estimular a cicatrização e a função imunológica tanto em animais quanto em humanos.
Conclusão
Portanto pode-se concluir que o GH promove um aumento da espessura dos espaços entre as miofibrilas, acúmulo de partículas de glicogênio nos quatro grupos analisados neste experimento. O treinamento de força promove maiores variações ultra-estruturais na miofibrila como os microtraumatismos promovendo um desarranjo estrutural dos miofilamentos, o acúmulo de glicogênio e um acúmulo de fibras de colágeno fatores que podem vir a expressar o aumento do volume de massa muscular após a administração do GH.
Referências
-
Powers, SK; Howley, ET. Exercise Physiology: Theory and application to itness and performance. Brown & Benchmark: Madison, Wisconsis, Iowa.p. 76-78; 94-95, 1990.
-
Keizer, HA; Rogol, AD. Physical exercise and mestrual cycle alterations: What are the mechanisms? Sports Medicine, 10(4):218-235, 1990.
-
Pombo, M. et al. Hormonal control of growth hormone secretion. Hormonal Research, vol. 55, p. 11-16, 2001.
-
Horber FF. Anabolika und Sport. Schweiz Med Wochenschr SWITZERLAND; 120(11):383-7, 1990.
-
Kraemer, WJ; Fleck, SJ; Dziados, JE; Harman, E; Marchitelli, LJ; Friedl, K;Harman, E; Maresh, C; Fry, AC. Endogenous anabolic hormonal and growth factor resposnse to heavy resistance exercise in males and females. Int. J. Sports Med. 12:228-235, 1991.
-
Bunt, JC; et al. Sex and training differences in human growth hormone levels during prologed exercise. J. Appl. Physiol. 61:1796-1801, 1986.
-
Sutton, J; Lazarus, L. growth hormone in exercise: Comparison of physiological and pharmacological stimuli. J. Appl. Physiol. 41:523-527, 1976.
-
Harridge, SD. Ageing and local growth factors in muscle. Scand J Med Sci Sports; Denmark, 13(1):34-9, 2003.
-
Salomon F, Cuneo R, Sönksen PH Growth hormone and protein metabolism. Horm Res 36(Suppl 1):41–43, 1991.
-
Goldberg AL, Goodman; HM Relationship between growth hormone and muscular work in determining muscle size. J Physiol (Lond) 200:655–666, 1969.
-
Linderman JK, Gosselink KL, Booth FW, Mukku VR, Grindeland RE Resistance exercise and growth hormone as countermeasures for skeletal muscle atrophy in hindlimb-suspended rats. Am J Physiol 267:R365–R371, 1994.
-
Russell-Jones DL, UmplebyM Protein anabolic action of insulin, growth hormone and insulin-like growth factor I. Eur J Endocrinol 135:631–642, 1996.
-
Marcus R, Butterfield G, Holloway L, Gilliland L, Baylink DJ, Hintz RL, Sherman BM Effects of short term administration of recombinant human growth hormone to elderly people. J Clin Endocrinol Metab 70:519–527, 1990.
-
Butterfield GE, Thompson J, Rennie MJ, Marcus R, Hintz RL, Hoffman AR Effect of rhGH and rhIGF-I treatment on protein utilization in elderly women. Am J Physiol 272:E94–E99, 1997.
-
Crist DM, Peake GT, Egan PA, Waters DL Body composition response to exogenous GH during training in highly conditioned adults. J Appl Physiol 65:579–584, 1988.
-
Jørgensen JO, Pedersen SA, Thuesen L, Jørgensen J, Ingemann-Hansen T, Skakkebaek NE, Christiansen JS Beneficial effects of growth hormone treatment in GH-deficient adults. Lancet 1:1221–1225, 1989.
-
Rudman D, Feller AG, Nagraj HS, Gergans GA, Lalitha PY, Goldberg AF, Schlenker RA, Cohn L, Rudman IW, Mattson DE Effects of human growth hormone in men over 60 years old. N Engl J Med 323:1–6, 1990.
-
Holloway L, Butterfield G, Hintz RL, Gesundheit N, Marcus R Effects of recombinant human growth hormone on metabolic indices, body composition, and bone turnover in healthy elderly women. J Clin Endocrinol Metab 79:470–479, 1994.
-
Richelsen B, Pedersen SB, Børglum JD, Møller-Pedersen T, Jørgensen J, Jørgensen JO Growth hormone treatment of obese women for 5 wk: effect on body composition and adipose tissue LPL activity. Am J Physiol 266:E211– E216, 1994.
-
Yarasheski KE, Zachwieja JJ, Campbell JA, Bier DM Effect of growth hormone and resistance exercise on muscle growth and strength in older men. Am J Physiol 268:E268–E276, 1995.
-
Lange KHW, Isaksson F, Juul A, Rasmussen MH, Bu¨low J, Kjær M Growth hormone enhances effects of endurance training on oxidative muscle metabolism in elderly women. Am J Physiol Endocrinol Metab 279:E989–E996, 2000.
-
Lange, K.H.W.; Andersen, J.L.; Beyer, N.; Isaksson, F.; Larsson, B.; Rasmussen, M.H.; Juul, A.; Bülow, J.; Kjaer, M. GH administration changes myosin heavy Caín isoforms in skeletal muscle but does not augment muscle strength or hypertrophy, either alone or combined with resístanse exercise training in healthy elderly men. The Jurnal of Clinical Endocrinology & Metabolism. Vol., 87, p., 513-523, 2002.
-
Frisch H. Growth hormone and body composition in athletes. J Endocrinol Invest ITALY; 22(5 Suppl):106-9, 1999
-
Aroniadou-Anderjaska V, Lemon PW, Gilloteaux J Effects of exogenous growth hormone on skeletal muscle of young female rats. Tissue Cell 28: 719–724, 1996.
-
Florini JR, Ewton DZ, Coolican SA Growth hormone and the insulin-like growth factor system in myogenesis. Endocr Rev 17:481–517, 1996.
-
Fisker S, Kristensen K, Rosenfalck AM, Pedersen SB, Ebdrup L, Richelsen B, Hilsted J, Christiansen JS, Jørgensen JO Gene expression of a truncated and the full-length growth hormone (GH) receptor in subcutaneous fat and skeletal muscle in GH-deficient adults: impact of GH treatment. J Clin Endocrinol Metab 86:792–796, 2001.
-
Fridén, J.; Sjöström, M.; Ekblom, B. A morphological study of delayed muscle soreness. Experientia. Vol., 37, p., 506-507, 1981.
-
Fridén, J.; Kjörell, U.; Thornell, L.E. Delayed muscle soreness and cytoskeletal alterations: An immunocytological study in man. International Journal Sports Medicine. Vol., 5, p., 15-18, 1984.
-
Silbernagl, S.; Despopoulos, A. Taschenatlas der Physiologie. 2ª ed. Aufl. Thieme Verlag, Stuttgart, p., 36, 1983.
-
Fridén, J.; Sjöström, M.; Ekblom, B. Myofibrillar damage following intense eccentric exercis in man. International Journal Sports Medicine. Vol., 4, p., 170-176, 1983.
-
Abraham, W.M. Factors in delayed muscle soreness. Medicine Science Sports. Vol., 9, p., 11-20, 1977.
-
Green, H.; Morikawa, M.; Nixon, T. A dual effector theory of growth-hormone action. Differentiation. Vol., 29, p., 195-198, 1985.
-
Steenfos H.H. Growth factors and wound healing. Scand Journal plast Reconstr Surgery Hand Surgery. Vol., 28, p., 95-105, 1994.
-
Rasmussen, L.H.; Garbarsch, C.; Scuppan, D.; Moe, D.; Horslev-Pedersen, K.; Gottrup, F.; Steenfos, H. Dose response profiles of human growth hormone in subcutaneous wound chambers in rats. European Journal Surgery. Vol., 161, p., 157-162, 1995.
-
Steenfos, H.H.; Jansson, J.O. Grwoth hormonestimulates granulation tissue formation and insulin-l;ike growth factor I gene expression in wound chambers in the rat. Journal Endocrinology, Vol., 132, p., 293-298, 1992.
-
Kopple, J.D. The rationale for the use of growth hormone or insuin-like growth factos I in adult patients with renal failure. Miner Electrlyte Metabolism. Vol., 18, p., 269-275, 1992.
-
Revhaug, A.; Mjaaland, M. Gorwth hormone and surgery. Hormone Research. Vol., 40, p., 99-101, 1993.
-
Park, J.H.Y.; VanderHoff, J.A. Growth hormone did not enhance mucosal hyperplasia after smallbowel resection. Scand. Journal gastroenterology. Vol., 31, p., 349-354, 1996.
-
Lobie, P.E.; Breipohl, W.; Lincoln, D.T. Localiztion of the growth hormone receptor/binding protein in skin. Journal Endocrinology. Vol., 126, p., 467-472, 1990.
-
Skottner, A.; Arrhenius-Nyberg, V.; Kanje, M.; Fryklund, L. Anabolic and tisuue repair functions of recombinat insulin-like growth hormone factor I. Acta Pediatric Scand. Vol., 367(Suppl), p., 63-66, 1990.
-
Belcher, H.J.; Ellis, H. Somatrotopin and wound healing after injury. Journal Clinical Endocrinology Metabolism. Vol., 70. p., 939, 1990.
-
Chrestensen, H.; Oxlunf, H.; Laurberg, S. Growth hormone increase the bursting strength of colonic anastomose. International Journal Colon Dis. Vol., 5, p., 130, 1990.
Outros artigos em Portugués
 |
|
|---|---|
|
revista
digital · Año 14 · N° 136 | Buenos Aires,
Septiembre de 2009 |
|