
|
|||
|---|---|---|---|
|
|
Angiogênese no músculo esquelético de ratos após exercício aeróbio de natação e exercício exaustivo La angiogénesis en el músculo esquelético de ratas después de un ejercicio aeróbico de natación y un ejercicio extenuante |
|
|
|
*Departamento de Ciências Básicas da Saúde Universidade Federal dos Vales do Jequitinhonha e Mucuri – UFVJM, Diamantina **Departamento de Biologia Geral Programa de Pós-Graduação em Biologia Celular e Estrutural Universidade Federal de Viçosa – UFV, Viçosa (Brasil) |
Edson da Silva* Izabel Regina dos Santos Costa Maldonado** Antônio José Natali** Sérgio Luís Pinto da Matta** |
|
|
|
Resumo O exercício físico e as contrações musculares criam um poderoso estímulo para a angiogênese do músculo esquelético de humanos e ratos. Vários fatores estão envolvidos na promoção da microvascularização deste tecido. O objetivo deste estudo foi analisar, através de análise histomorfométrica, se o protocolo de exercício exaustivo adotado induziria alterações na microvascularização dos músculos sóleo (SO) e reto femoral (RF) de ratos Wistar treinados e sedentários. Utilizou-se 29 ratos divididos em quatro grupos: CS: controle sedentário (n=8); SE: sedentário seguido de teste de exaustão (n=7); TN: 17 semanas de natação (n=7); TNE: 17 semanas de natação seguido de teste de exaustão (n=7). Os animais dos grupos TN e TNE nadaram 5 vezes/semana, 90 min./dia, durante 17 semanas. Quarenta e oito horas após a última sessão de treino, os animais dos grupos CS e TN foram eutanasiados, enquanto os animais dos grupos SE e TNE foram submetidos a um teste de exaustão em natação suportando um peso de 4% do peso corporal fixo ao corpo. Após 48 horas do teste de exaustão, os animais dos grupos SE e TNE foram eutanasiados. Com a análise morfológica observou-se que a microvascularização no músculo SO aumentou nos grupos TN e TNE, enquanto no RF ocorreu aumento significativo apenas no grupo TNE. Isso indica que o exercício exaustivo adotado foi capaz de induzir alterações na microvascularização dos músculos estudados. Unitermos: Exercício exaustivo. Angiogênese. Densidade capilar. Músculo esquelético |
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 14 - Nº 136 - Septiembre de 2009 |
|
|
1 / 1
Introdução
A angiogênese é um processo complexo envolvendo a germinação ou o brotamento de células endoteliais de micro vasos pré-existentes seguido pelo desenvolvimento de novos vasos. Além de apresentar-se no período embrionário, esse fenômeno pode manifestar-se na fase adulta, ser observado mensalmente na mulher durante o ciclo menstrual (Favier, 2001), durante a atividade física e a eletroestimulação (Amaral et al., 2008).
O exercício físico e a contração muscular constituem num poderoso estímulo para a remodelação estrutural vascular em humanos e animais de laboratório (Adolfsosson et al., 1981; Prior, Yang & Terjung, 2004; Bloor, 2005).
A densidade capilar no músculo esquelético é aumentada pelo treinamento com exercício aeróbio e esse aumento é variável entre os diferentes tipos de fibras musculares (Adolfsosson et al., 1981; Williams & Annex, 2004).
Recentes estudos utilizando o exercício exaustivo com recrutamento predominante de fibras glicolíticas demonstram um rápido aumento no tamanho de capilares precedido pelo aumento do Fator de Crescimento Endotelial Vascular - VEGF (Suzuki, 2004; Waters et at., 2004). Este tipo de treinamento também resultou no aumento de capilares, primeiro ao redor das fibras glicolíticas (Suzuki, 2004), as quais apresentaram mais altos níveis de mRNA VEGF após o exercício exaustivo (Birot et al., 2003).
Vários fatores estão envolvidos na promoção da microvascularização do músculo esquelético em resposta ao exercício físico (Risal, 1997; Prior, Yang & Terjung, 2004), entre eles angiopoietina 1 (Ang1), angiopoietina (Ang2), metaloproteinases de membrana (MMP), ativador do plasminogênio do tipo uroquinase (uPA), ativador do plasminogênio tecidual (tPA), fator de crescimento de fibroblasto básico b-FGF (Bloor, 2005; Efthimiadou et al., 2006), fatores mecânicos ligados ao aumento da tensão da parede capilar (Munzenmaier, 1996; Hudlicka & Brown, 1996), hipóxia (Olfert et al., 2003) e espécies reativas de oxigênio (Ushio-Fukai & Alexander, 2004). O VEGF parece ser o fator central no processo da angiogênese no músculo esquelético (Williams & Annex, 2004; Bloor, 2005). É considerado o mais importante promotor de crescimento capilar no músculo submetido ao aumento de atividade (Milkiewiscz et al., 2005). Quando os níveis de VEGF estão baixos no músculo esquelético ocorre uma diminuição da densidade capilar e da relação de capilares por fibra muscular, acompanhado pelo aumento de apoptose destas células (Gale & Yancopoulos, 1990). A revascularização tecidual é estimulada pelo próprio tecido sob hipóxia, desencadeando a proliferação e reorganização das células endoteliais vasculares (Grounds, 1991).
Assim, a hipóxia é o mais potente estímulo que inicia a angiogênese de capilares. Ela exerce seu efeito principalmente através da regulação de VEGF quando o músculo está em atividade e com uma baixa pressão parcial de O2 (Shweiki et al., 1995). O VEGF pode ser estimulado também por outros fatores incluindo oxido nítrico, angiotensina II e metabólitos do ácido aracdônico (Amaral et al., 2008). Contudo, o objetivo deste estudo foi analisar, através de análise histomorfométrica, se o protocolo de exercício exaustivo adotado induziria alterações na microvascularização dos músculos sóleo (SO) e reto femoral (RF) de ratos Wistar treinados e sedentários.
Métodos
Animais
Foram utilizados 29 ratos (Rattus norvegicus, albinus) Wistar, adultos, com 90 dias de idade. Os animais foram obtidos no Biotério Central do Centro de Ciências Biológicas e da Saúde da Universidade Federal de Viçosa, CCB/UFV. Todos os procedimentos foram realizados de acordo com os Princípios Éticos na Experimentação Animal elaborados pelo Colégio Brasileiro de Experimentação Animal (COBEA).
Os animais foram alojados em gaiolas coletivas (4 animais por gaiola), recebendo água e ração própria ad libitum e mantidos em ambiente com temperatura média de 24oC e regime de luminosidade de doze horas de escuridão por doze horas de claridade.
Os animais foram alocados aleatoriamente em 4 grupos: Grupo CS: controle - sedentário sem tratamento, n = 8; Grupo SE: sedentário seguido de exaustão, n = 7; Grupo TN: 17 semanas de treinamento em natação, n = 7; Grupo TNE: 17 semanas de treinamento em natação, seguidas de um teste de exaustão em natação, n = 7.
Programa de treinamento aeróbio em natação
O protocolo de exercício foi adaptado de Bolter & Gordon (1983), com treinamento progressivo de natação. O treinamento foi realizado num tanque de alvenaria (largura: 65 cm, comprimento: 75 cm, altura: 85 cm), a altura da água a 45 cm. A temperatura da água foi mantida em 32°C ± 1°C. Nadaram simultaneamente 8 animais em cada tanque. O programa de treinamento foi composto de uma sessão diária, 5 dias por semana e durou 17 semanas. As sessões de treinamento começaram com duração de dez minutos, sendo aumentadas de dez minutos a cada dia, chegando aos noventa minutos no nono dia, e mantidas assim, até o final do experimento. Esta atividade é considerada uma atividade aeróbia (Peijie et al., 2004), ou seja, abaixo do limiar de lactato (Gobatto et al., 2001).
Protocolo de Exercício Exaustivo
Quarenta e oito horas após a última sessão de treinamento, os animais dos grupos SE e TNE foram submetidos a um teste exaustivo em natação. Os animais foram forçados a nadar até a exaustão, suportando um peso de 4% do peso corporal fixo ao corpo (Vendetti & Di Meo, 1996). A exaustão foi definida como o ponto onde o rato permaneceu 10 segundos sob a superfície da água (Dawson & Horvath, 1970).
Coleta do material
Quarenta e oito horas após a última sessão de treinamento, os animais dos grupos CS e TN foram eutanasiados para a remoção dos músculos, enquanto, os animais dos grupos SE e TNE só foram sacrificados 48 horas após o teste de exaustão. Realizou-se a coleta dos músculos sóleo e reto femoral do lado esquerdo de cada animal.
Microscopia de Luz
Fragmentos dos músculos sóleo e reto femoral foram fixados em paraformaldeído a 4% em tampão fosfato 0,1M, pH 7,2-7, 4, incluídos em parafina e seccionados com espessura de 2 µm em micrótomo rotativo (Reichert-Jung 2045 Multicut, Germany), desparafinizados em xilol e hidratados em álcool para coloração com Azul de Toluidina-pironina. Estas preparações foram analisadas em microscópio binocular acoplado a um sistema de captura de imagens para a morfometria.
Análise morfométrica
A análise morfométrica foi realizada utilizando o programa de análise de imagem (Image Pro Plus, versão 4.5 para Windows 98), determinando a freqüência de vasos sanguíneos intramusculares. Foram capturadas 10 imagens de cada animal, utilizando-se o programa SPOT, versão 3.5.9, e objetiva com aumento de 20x e zoom de 1,25x. Com uma grade de 80 intersecções por imagem e total de 800 intersecções por animal, contou-se a freqüência de vasos sangüíneos (Fig. 1).
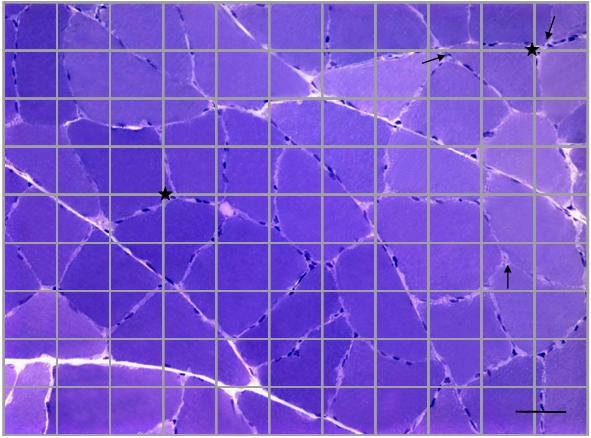
Figura 1. Imagem adaptada da grade do programa Image Pro Plus, aplicada sobre campo microscópico, em secção transversal do músculo
sóleo de rato Wistar adulto (Coloração: Azul de toluidina-pironina). Setas: vasos sanguíneos. Estrela: Intersecções. Barra: 20mm.
Análise estatística
As médias referentes aos valores da morfometria foram comparadas entre os grupos por meio de análise de variância (ANOVA) seguida pelo teste de Duncan. Foi utilizado o software STATISTICA for Windows 3.11, sendo o nível de significância de p>0,05.
Resultados
Análise histológica dos músculos sóleo e reto femoral
Os resultados da avaliação histológica indicam que nos animais deste estudo, os músculos sóleo e reto femoral foram recrutados durante a natação. Após a exaustão, o grupo TNE mostrou aumento significativo (p<0,05) de vasos sanguíneos (99,14 ± 12,56) no músculo reto femoral em relação aos grupos SE e TN (Tab. 1). No músculo sóleo, o grupo TNE também apresentou um aumento significativo na freqüência de vasos sangüíneos em relação aos grupos CS e SE (Tab. 2).
Tabela 1. Freqüência de vasos sangüíneos intramusculares no reto femoral (RF)
de ratos Wistar sedentários e treinados (Média ± desvio padrão)
|
Grupos |
Vasos sangüíneos |
|
CS (n=8) |
63,87 ± 56,13 ab |
|
SE (n=7) |
54,29 ± 41,24 b |
|
TN (n=7) |
54 ± 18,12 b |
|
TNE (n=7) |
99,14 ± 12,56 a |
Médias, nas colunas seguidas com letras iguais não diferem significativamente entre si (p>0,05), pelo teste de Duncan. Grupo CS: controle sedentário; Grupo SE: sedentário + exaustão; Grupo TN: Treinado; Grupo TNE: treinado + exaustão.
Tabela 2. Freqüência de vasos sangüíneos intramusculares no sóleo (SO)
de ratos Wistar sedentários e treinados. (Média ± desvio padrão)
|
Grupos |
Vasos sangüíneos |
|
CS (n=8) |
157,25 ± 47,91 b |
|
SE (n=7) |
148,29 ± 53,50 b |
|
TN (n=7) |
200,71 ± 27,35 ab |
|
TNE (n=7) |
239,71 ± 62,97 a |
Médias, nas colunas seguidas com letras iguais não diferem significativamente entre si (p>0,05), pelo teste de Duncan. Grupo CS: controle sedentário; Grupo SE: sedentário + exaustão; Grupo TN: Treinado; Grupo TNE: treinado + exaustão.
Discussão
Para manter o balaço funcional entre demanda e liberação de oxigênio, os músculos esqueléticos e o miocárdio aumentam a densidade capilar e/ou a relação de capilares por fibra muscular, desenvolvendo um importante papel na melhoria da capacidade aeróbia e no desempenho físico (Amaral et al., 2008).
Quanto à freqüência de vasos sanguíneos nos músculos reto femoral e sóleo, os resultados deste trabalho corroboram com achados de alguns autores. Adolfsson et al., (1981) demonstraram que ratos treinados em natação, uma hora por dia, cinco dias na semana durante um período de três semanas aumentaram significativamente a densidade capilar do músculo quadríceps femoral. Este aumento foi proporcionalmente maior nos animais jovens, com peso corporal inicial de 100g, do que em ratos adultos com peso inicial de 200g. Entretanto, Efthimiadou et al., (2006) ao estudar o efeito da administração intramuscular do fator de crescimento de fibroblasto-básico (b-FGF) e da natação, verificaram aumento significativo do número de vasos sanguíneos no músculo gastrocnêmio dos animais do grupo tratado com doses de 1µl de b-FGF a cada três dias, durante um período de 15 dias. Um grupo de animais exercitados recebeu as mesmas doses de b-FGF do grupo anterior além da prática de natação uma vez por dia, durante 15 dias, e os animais apresentaram aumento significativo da neovascularização em relação aos animais do grupo controle sedentário sem tratamento. Um terceiro grupo realizou apenas a natação diária por 15 dias e apresentou redução significativa do número de vasos sanguíneos no gastrocnêmio. Segundo Efthimiadou et al., (2006), a natação parece diminuir a vascularização no músculo gastrocnêmio comparado com o grupo controle, provavelmente como resultado de mudanças com aumento da massa muscular (hipertrofia).
Após a exaustão, o grupo TNE mostrou aumento significativo (p<0,05) de vasos sanguíneos no músculo reto femoral e no músculo sóleo em relação aos grupos SE e TN (Tab. 1). Esses resultados corroboram com as pesquisas de Suzuki et al., (2004) e Waters et al., (2004) os quais encontram aumentos no tamanho e no número de capilares após o exercício exaustivo.
Sabe-se que o exercício físico e a contração muscular constituem num poderoso estímulo para a remodelação estrutural vascular. Segundo Bloor (2005), a densidade capilar no músculo esquelético é significativamente aumentada pelo treinamento com exercício aeróbio, embora, alguns programas de treinamento de resistência possam resultar em hipertrofia de fibras musculares com aumento da área das fibras e uma aparente diminuição dos capilares. A aparente diminuição de vasos sanguíneos seria resultado do ganho proporcionalmente maior de massa muscular em relação ao desenvolvimento de novos vasos sanguíneos, como foi referido também por Efthimiadou et al., (2006).
Laughlin et al., (1984) encontraram um fluxo sanguíneo significativamente maior nos músculos extensores do tornozelo, com exceção do sóleo e da porção branca do gastrocnêmio, e nos músculos extensores do joelho, com exceção da porção branca do vasto lateral e do reto femoral, indicando que os músculos sóleo e reto femoral são pouco ativos durante a natação. Roy et al., (1991) estudaram os padrões eletromiográficos de músculos extensores e flexores do joelho de ratos submetidos à locomoção, durante os exercícios em esteira e natação. Segundo estes autores, a natação parece ser uma atividade que impõe menor carga sobre os músculos antigravitacionais (predominância de fibras oxidativas) como o sóleo, quando comparados com os gravitacionais como o tibial anterior. Os resultados indicam que nos animais de nosso estudo, os músculos sóleo e reto femoral foram ativamente recrutados durante a natação com o protocolo utilizado. No entanto, deve-se considerar que durante a fase experimental desta pesquisa, os animais submetidos ao treinamento em natação adotaram a prática de saltos com grande freqüência. Diante da iminência de fadiga os ratos nadavam até o fundo do tanque e a partir de um impulso vigoroso realizavam movimentos rápidos de flexão e extensão dos membros posteriores. Com isso os músculos dos membros anteriores trabalharam continuamente na natação, enquanto nos membros posteriores os músculos possivelmente exerceram maior trabalho total, pois realizaram saltos intercalados com a natação. Essa prática de saltos durante o período de 17 semanas de treinamento sugere a ocorrência de uma ação muscular com maior recrutamento dos músculos sóleo e reto femoral durante o treinamento o que poderia contribuir para a ocorrência de aumento da densidade de vasos sanguíneos nos componentes intramusculares ao se considerar a pequena ação de tais músculos durante a natação, referida por Laughlin et al., (1984) e Roy et al., (1991).
Dessa forma, conclui-se com os resultados desta pesquisa que o exercício aeróbio em natação e o exercício exaustivo podem se constituir em reestruturação morfológica no músculo esquelético de ratos sedentários e treinados. Constatamos que existe de fato uma correlação positiva entre o exercício físico e a angiogênese. O exercício exaustivo correlacionou-se com a maior densidade de vasos sanguíneos no tecido muscular. A microvascularização no músculo sóleo aumentou nos grupos TN e TNE, enquanto no reto femoral ocorreu aumento significativo apenas no grupo TNE. É possível que a neovascularização durante o treinamento e o exercício exaustivo seja dependente do tipo do protocolo de exercício realizado e que os comportamentos adotados pelos animais durante o treinamento possam ter induzido adaptações, sobretudo nos grupos de animais submetidos à exaustão, contudo mais pesquisas devem ser realizadas para uma determinação mais precisa da relação entre o treinamento em natação e o exercício exaustivo sobre a microvascularização do músculo esquelético de ratos Wistar.
Agradecentos
Os autores agradecem a Fundação de Amparo à Pesquisa do Estado de Minas Gerais (FAPEMIG) pelo apoio ao projeto.
Referencias bibligráficas
-
ADOLFSSON, J.; LJUNGQVIST, G.; TORNLING, G.; UNGE, G. Capillary increase in the skeletal muscle of trained young and adult rats. The Journal of Physiology. v. 310, p. 529-532, 1981.
-
AMARAL, S.L.; SANCHEZ, L.S.; CHANG, A.J.B.A.; ROSSONI, L.V.; MICHELINI, L.C. Time course of training-induced microvasculatory changes and of VEGF expression in skeletal muscles of spontaneously hypertensive female rats. Brasilian Journal of Medical and Biological Research. v. 41, p. 424-431, 2008.
-
BIROT, O.J.; KOULMANN, N.; PEINNEQUIN, A.; BIGARD, X.A. Exercise induced expression of vascular endothelial growth factor mRNA in rat skeletal muscle is dependent on fiber type. Journal Physiology. v. 552, p. 213–221, 2003.
-
BLOOR, C.M. Angiogenesis during exercise and training. Angiogenesis. v. 8, p. 263-271, 2005.
-
BOLTER, C.P.; GORDON, B.L. Cholinergic responses of isolated atria from swim-trained rats. European Journal of Applied Physiology. v. 51, p. 231-236, 1983.
-
DAWSON, C.A., HORVARTH, S.M. Swimming in small laboratory animals. Medicine and Science in Sports and Exercise. v. 2, p. 51-78, 1970.
-
EFTHIMIADOU, A.; ASIMAKOPOULOS, B.; NIKOLETTOS, N.; GIATROMANOLAKI, A.; SIVRIDIS, E.; PAPACHISTOU, E.K. Angiogenic effect of intramuscular administration of basic and acidic fibroblast growth factor on skeletal muscles and influence of exercise on muscle angiogenesis. British Journal of Sports Medicine. v. 40, p. 35-39, 2006.
-
FAVIER, J; CORVOL, P. Physiological angiogenesis. Therapies. v.56, p.455-63, 2001.
-
GALE, N.W.; YANCOPOULOS, G.D. Growth factors acting via endothelial cell-specific receptor tyrosine kinases: VEGFs, angiopoietins, and ephrins in vascular development. Genes & Development. v.13, p. 1055–1066, 1999.
-
GROUNDS, M.D. Towards understanding skeletal muscle regeneration. Pathology Research and Practice. v.187, p. 1-22, 1991.
-
GOBATTO, C.A.; MELLO, M.A,R.; SIBUYA, C.Y.; AZEVEDO, J.R.M.; SANTOS, L.A.; KOKUBUN, E. Maximal lactate steady state in rats submitted to swimming exercise. Comparative Biochemistry and Physiology. v.130 (A), p. 21-27, 2001.
-
HUDLICKA, O.; BROWN, M.D. Postnatal growth of the heart and its blood vessels. Journal of Vascular Research. v. 33, p. 266-287, 1996.
-
LAUGHLIN, M.H.; MOHRMAN, S.J.; AMSTRONG, B. Muscular blood flow distribution patterns in the hindlimb of swimming rats. The American Journal of Physiology. v. 246, n.15, p.H398-H403, 1984.
-
MILKIEWICZ, M.; HAAS, T.L. Effect of mechanical stretch on HIF-1 α and MMP-2 expression in capillaries isolated from overloaded skeletal muscles: laser capture microdissection study. The American Journal Heart Circulation Physiology. v.289, p. H1315–H1320, 2005.
-
MUNZENMAIER, D.H.; GREENE, A.S. Opposing actions of angiotensin II on microvascular growth and arterial blood pressure. Hypertension. v. 27, p. 760-765, 1996.
-
OLFERT, I.M; BREEN, E.C.; MATHIEU-COSTELLO, O.; WAGNER, P.D. Skeletal muscle capillarity and angiogenic mRNA levels after exercise training in normoxia and chronic hypoxia. Journal of Applied Physiology. v. 91, p. 1176-1184, 2001.
-
PEIJIE, C.; ZICAI, D.; HAOWEEN, X.; RENBAO, X. Effects of chronic and acute training on glucocorticoid receptors concentrations in rats. Life Sciences. v. 75, p. 1303-1311, 2004.
-
PRIOR, B.M.; YANG, H.T.; TERJUNG, R.L. What makes vessels grow with exercise training? Journal of Applied Physiology. v.97, p.1119-1128, 2004.
-
ROY, R.R.; HUTCHISON, L.D.; PIEROTTI, J.D.; HODGSON, J.A.; EDGERTON, V.R. EMG patterns of rat ankle extensors and flexors during treadmill locomotion and swimming. Journal of Applied Physiology. v. 70, n. 6, p. 2522-2529, 1991.
-
RISAU W. Mechanisms of angiogenesis. Nature. v. 386, p. 671-674, 1997.
-
SHWEIKI, D.; NEEMAN, M.; ITIN, A. KESHET, E. Induction of vascular endothelial growth factor expression by hypoxia and by glucose deficiency in multicell spheroids: Implications for tumor angiogenesis. Proceedings of the National Academy of Sciences. v. 92, p. 768−772 , 1995.
-
SUZUKI. J. Time-course of changes in VEGF expression and capillarity in the early stages of exercise training with Co treatment in rat skeletal muscle. Acta Physiologic Scandinavica. v.181, p.225–232, 2004.
-
WATERS, R.E.; ROTEVATN, S.; LI, P.; ANNEX, B.H.; YAN, Z. Voluntary running induces fiber type-specific angiogenesis in mouse skeletal muscle. The American Journal Physiology – Cell Physiology. v. 287, p.C1342–C1348, 2004.
-
WILLIAMS, S.R.; ANNEX, B.H. Plasticity of myocites and capillaries: a possible coordinating role for VEGF. Circulation Research. v.94, p. 7-8, 2004.
-
USHIO-FUKAI, M.; ALEXANDER, RW. Reactive oxygen species as mediators of angiogenesis signaling: role of NAD (P) Hoxidase. Molecular and Cellular Biochemistry. v. 264, p. 85-97, 2004.
-
VENDETTI, P., Di MEO, S. Antioxidants, tissue damage, and endurance in trained and untrained young male rats. Archives of Biochemistry and Biophysics. v. 331, p. 63-68, 1996.
Outros artigos em Portugués
 |
|
|---|---|
|
revista
digital · Año 14 · N° 136 | Buenos Aires,
Septiembre de 2009 |
|