
|
|||
|---|---|---|---|
|
|
Mecanismos de proteção contra o câncer
colorretal pelo exercício e atividade física Mechanisms of protection against colorectal cancer by exercise and physical activity |
|
|
|
*Mestre em Ciência da Nutrição pela Universidade Federal de Viçosa, Minas Gerais. **Professora do Centro Universitário Vila Velha (UVV), Espírito Santo (Brasil) |
Wellington Lunz* Ana Paula Boroni Moreira* Elaine Cristina Viana* ** wwwlunz@gmail.com |
|
|
|
|
|||
|
|
http://www.efdeportes.com/ Revista Digital - Buenos Aires - Año 11 - N° 102 - Noviembre de 2006 |
|
|
1 / 1
Introdução
Os tumores malignos que acometem o cólon e o reto são a quarta causa mais comum de câncer no mundo (INCA, 2005). A inatividade física, entre outros fatores relacionados ao estilo de vida, está associada ao risco aumentado de câncer colorretal (CC) (Tomlinson et al., 1997). Em contrapartida, o exercício e a atividade física (AF) estão inversamente associados ao CC (Andrianopoulos et al., 1987; Reddy et al., 1988; Hauret et al., 2004; Hou et al., 2004). Ressalta-se que AF é o movimento corporal, produzido pelos músculos esqueléticos, que resulta em gasto energético maior que o de repouso. E exercício físico é toda atividade física planejada, estruturada e repetitiva que objetiva a melhoria e manutenção de um ou mais componentes da aptidão física (ACSM, 2003).
Dezenas de estudos relacionando AF com o CC já foram realizados. Em estudo de revisão utilizando-se todas as publicações (bases Medline e PubMed) que relacionavam AF, exercício e câncer de cólon e reto, sem restrição para idioma ou ano de publicação, observou-se que dos 51 estudos encontrados, 43 demonstraram alta redução no risco de CC para homens e mulheres mais fisicamente ativos. A redução média do risco foi de 40-50%, e fatores de confusão foram geralmente controlados para que o efeito independente da AF pudesse ser observado (Friedenreich e Orenstein, 2002). Em revisões anteriores (Colditz et al., 1997; Friedenreich, 2001) e estudos originais posteriores (Hauret et al., 2004; Hou et al., 2004) a redução média do risco de CC também foi de 40-50% nos indivíduos com maiores níveis de AF.
Devido à magnitude das evidências, a proteção contra o CC pela AF é tida como "convincente". O mesmo ocorre para o câncer de mama. Para o câncer de próstata, entretanto, é considerado como "provável", para os cânceres de pulmão e endométrio é considerado como "possível" e para os cânceres de testículo e ovário ainda é "insuficiente" fazer qualquer afirmação (Friedenreich, 2001; Friedenreich e Orenstein, 2002).
Por outro lado, estudos com modelos animais são escassos e não apresentam resultados consensuais quanto ao efeito protetor do exercício para o CC. Em ratos com carcinogênese colorretal induzida por carcinógenos químicos, o exercício voluntário (roda livre) foi capaz de reduzir a incidência (Andrianopoulos et al., 1987; Reddy et al., 1988) e multiplicidade de tumores (tumor/animal) (Reddy et al., 1988). O exercício forçado (esteira), de intensidade moderada, promoveu redução significativa no número de adenocarcinomas no cólon (Thorling et al., 1993) e no número de focos de criptas aberrantes (FCA) (Oliveira e Chaves-Dias, 2003), que são consideradas lesões pré-neoplásicas do CC (Bird, 1987). Em estudo recente (dados não publicados) também observamos redução significativa no número de FCA de ratos submetidos ao treinamento moderado de natação (5 dias/sem; 20 min/sessão; 2% peso corporal) por 35 semanas, comparado ao grupo não exercitado. O número de tumores nas regiões proximal, média e distal também foi menor para o exercício moderado, mas a redução não foi significativa do ponto de vista estatístico.
Camundongos conhecidos como APCmin ou Min mouse, os quais são predispostos geneticamente ao desenvolvimento de múltiplos adenomas intestinais (MIN = multiple intestinal neoplasia), não apresentaram redução significativa no número de tumores no intestino grosso quando submetidos aos exercícios forçado (Colbert et al., 2000; Mehl et al., 2005), voluntário (Mehl et al., 2005) e misto (voluntário + forçado) (Colbert et al., 2003). Além disso, ratos submetidos a uma sessão exaustiva de natação, seguido da aplicação de carcinógeno químico, apresentaram aumento significativo no número de FCA quinze dias após a sessão de treino (Demarzo e Garcia, 2004).
A quase totalidade dos estudos com modelo animal supracitados, entretanto, não estudou qualquer dos possíveis mecanismos de proteção do CC pelo exercício e AF que têm sido sugeridos por estudos observacionais. Acredita-se que a proteção contra o CC pelo exercício e AF seja via modulação do hormônio insulina, dos fatores de crescimento semelhantes a insulina (IGFs), da obesidade, do tempo de trânsito gastrointestinal, da taxa de prostaglandinas E / F (PGE/PGF), do balanço energético, do sistema imune ou de agentes oxidantes (radicais livres) (Colditz et al., 1997; Friedenreich e Orenstein, 2002; Westerlind 2003).
Devido a necessidade de estudos intervencionais que permitam revelar o(s) mecanismo(s) pelos quais o exercício previne do CC, o presente estudo tem por objetivo apontar e discutir os mecanismos biológicos possivelmente envolvidos na proteção contra o CC pelo exercício e AF. Pretende-se, desta forma, indicar o foco dos próximos estudos envolvendo exercício e CC.
Possíveis mecanismos envolvidos na proteção contra o câncer colorretal pelo exercício e atividade físicaVários mecanismos estão associados ao maior risco de desenvolvimento do CC. Entre estes mecanismos estão os níveis elevados de insulina, de fatores de crescimento, obesidade, aumento do tempo de trânsito gastrointestinal, altos níveis de prostaglandinas E e o balanço energético positivo. Outros mecanismos possivelmente envolvidos na maioria dos cânceres como a supressão imune e o aumento de radicais livres são também sugeridos como "causais" para o CC (Friedenreich e Orenstein, 2002; Westerlind 2003). A discussão sobre como o exercício e AF podem agir na prevenção do CC envolve a modulação desses mecanismos biológicos.
Insulina e fatores de crescimento semelhantes à insulina (IGFs)Concentrações elevadas do hormônio insulina associam-se positivamente com o CC e com vários outros tipos de cânceres, como os cânceres de fígado, pâncreas, mama e endométrio (Westerlind, 2003). A insulina age como fator de crescimento para células da mucosa colônica (Colditz et al., 1997; Westerlind 2003), além de se associar com níveis aumentados das proteínas IGFs e de estimular receptores de IGFs (Friedenreich e Orenstein, 2002; Westerlind, 2003).
Níveis aumentados de IGFs estão associados a maior incidência de CC (Friedenreich e Orenstein, 2002). Os IGFs realizam papel importante na regulação da proliferação celular e diferenciação, além de apresentar efeito anti-apoptótico em várias células cancerosas. O sistema apoptótico é composto por sinais "pró-vida" e sinais "pró-morte". Os IGFs I e II, as duas isoformas de IGFs conhecidas, fazem parte dos sinais "pró-vida", e sinalizam para a sobrevivência celular (Louro, 2000). Os IGFs também agem sinergicamente com outros fatores de crescimento e esteróides, e antagonizam o efeito de moléculas anti-proliferativas do crescimento tumoral (Yu e Rohan, 2000).
Em estudo com adenocarcinomas do cólon humano se observou níveis de IGF-II 40 vezes superiores ao encontrado no tecido colônico adjacente, e os níveis de receptores de IGF-I foram 2,5 vezes superiores (Freier et al., 1999). Em células cancerosas isoladas (HT29 cells) que apresentavam receptores de IGF-I truncados, ou seja, incapazes de reconhecer a proteína IGF-I (e possivelmente o IGF-II), observou-se apoptose aumentada, inibição do crescimento e proliferação celular e redução da quantidade de vasos sanguíneos. A inibição do crescimento de tumores no cólon de camundongos que receberam os receptores de IGF-I truncados (via injeção) também foi observada (Reinmuth et al., 2002).
Acredita-se também que a hiperinsulinemia seja capaz de reduzir os níveis das proteínas ligantes de IGFs (IGFBPs) (Westerlind, 2003). As IGFBPs se ligam aos IGFs e, desta forma, diminuem a concentração de IGFs livres. Ressalta-se, entretanto, que das seis isoformas existentes de IGFBPs, algumas podem aumentar a ação dos IGFs (Yu e Rohan, 2000). Um perfil de altos níveis de IGFs circulantes e baixos níveis de IGFBPs, em particular a isoforma IGFBP-3 (Yu e Rohan, 2000), está associado com o risco aumentado de CC (Friedenreich, 2001).
A AF, por sua vez, se mostra capaz de reduzir os níveis de insulina plasmática, em indivíduos normais e insulino-resistentes, e de aumentar a sensibilidade insulínica (Colditz et al., 1997; Friedenreich, 2001; Westerlind, 2003), permitindo sugerir que este possa ser o mecanismo pelo qual pessoas fisicamente ativas possam se proteger contra o CC. Entretanto, os resultados são controversos. Camundongos machos (APCmin) exercitados por 8 semanas (corridas voluntária e forçada) apresentaram concentração sérica de insulina significativamente superior (duas vezes maior) que o grupo controle. Apesar desse resultado, os autores não verificaram diferença estatística para o número de pólipos entre animais exercitados e controle. Também não verificaram associação entre níveis de insulina e o número de pólipos no intestino grosso (Colbert et al., 2003).
Acredita-se que a AF reduz os níveis de IGFs e, por este mecanismo, poderia proteger contra o CC. Essa ação da AF sobre os IGFs parece ser indireta. Sugere-se que a AF aumenta a concentração sérica das IGFBPs que, por sua vez, reduz a concentração livre de IGFs (Friedenreich, 2001). Os resultados do efeito do exercício sobre os níveis de IGFs, entretanto, também não são consensuais. Por exemplo, observou-se que o exercício pode aumentar, reduzir ou não ter qualquer efeito (Yu e Rohan, 2000; Colbert et al., 2003; Westerlind, 2003) sobre os níveis de IGF-I. É possível que a modulação dos níveis de IGFs pelo exercício ocorra via balanço energético negativo (Nemet et al., 2004). Mais estudos experimentais, no entanto, são necessários para avaliar se a proteção contra o CC pelo exercício e AF são, de fato, devido a modulação do hormônio insulina ou IGFs.
ObesidadeA obesidade está associada com o risco aumentado de CC (Slattery et al., 2002; Hauret et al., 2004; Hou et al., 2004; Tsushima et al.; 2005), e com vários outros tipos de cânceres (ex: mama, rim, esôfago, endométrio, tiróide) (Mctiernan, 2003), possivelmente, por sua associação com o metabolismo de estrogênio, resistência insulínica, hiperinsulinemia e níveis elevados de IGFs (Westerlind, 2003). Discute-se que a massa de gordura abdominal, por promover resistência insulínica e hiperinsulinemia, esteja implicada em maior grau na carcinogênese (Colditz et al., 1997; Friedenreich, 2001; Westerlind, 2003).
Sabe-se que a prevalência crescente de sobrepeso e obesidade nas sociedades ocidentais é devida, em grande parte, a um declínio global no dispêndio energético diário promovido pela AF (The Cancer Council Austrália, 2004). A redução da obesidade mediada pelo exercício e AF poderia explicar a proteção contra o CC (Friedenreich, 2001; Friedenreich e Orenstein, 2002).
Em contrapartida, discute-se que o exercício e AF possam proteger contra o CC independentemente de seus efeitos sobre o controle do peso (The Cancer Council Australia, 2004; Batty e Thune, 2000). Estudos observacionais frequentemente observam efeitos protetores pela AF independente da perda de peso ou redução do IMC (Westerlind, 2003). Por outro lado, camundongos APCmin exercitados por 8 semanas (corridas voluntária + forçada), apesar de apresentarem menores peso corporal e massa de gordura, não apresentaram número significativamente menor de pólipos intestinais comparado ao grupo não exercitado (Colbert et al., 2003). Em estudo recente (Lunz 2006) observamos que ratos Wistar, com carcinogênese colorretal induzida por 1,2-dimetilhidrazina (DMH), após submetidos ao treinamento em natação (5-20 min/sessão; 5 dias/semana; sobrecarga de 2% do peso corporal) por 35 semanas apresentaram menor número de lesões pré-neoplásicas (focos de criptas aberrantes - FCA) que o grupo não exercitado. Apesar desse resultado, os dois grupos não apresentaram diferença para o ganho de peso e percentuais de gordura da carcaça e intra-abdominal, sugerindo que a proteção contra a carcinogênese colorretal pelo exercício ocorreu de forma independente da modulação da gordura corporal. Devido aos resultados controversos, novos estudos são necessários.
Tempo de trânsito gastrointestinalA redução da motilidade intestinal aumenta o tempo de exposição de carcinógenos sobre a mucosa colônica (Friedenreich, 2001) permitindo, por exemplo, que o excesso de ácidos biliares livres (ex: ácidos cólico e deoxicólico), ácidos graxos não absorvidos e o próprio ressecamento fecal agridam o epitélio colônico. A agressão sobre o tecido colônico poderia conduzir a uma proliferação compensatória para regenerar o tecido e, desta forma, facilitar a carcinogênese colorretal (Montoya e Wargovich, 1997).
O exercício e AF, por sua vez, aumentam a motilidade do intestino, reduzindo o tempo de trânsito gastrointestinal e, consequentemente, o tempo de exposição da mucosa a carcinógenos (Colditz et al., 1997; Batty e Thune, 2000; Friedenreich, 2001). Entretanto, o limitado número de estudos envolvendo exercício, tempo de trânsito intestinal e CC não permitem concluir se este é o mecanismo pelo qual o exercício e AF protegem contra o CC.
Prostaglandinas E e FProstaglandinas são substâncias semelhantes a hormônios, com diversas funções no organismo (Montoya e Wargovich, 1997). Prostaglandinas podem contribuir tanto para a proliferação de células do cólon quanto para a não proliferação. Por exemplo, as prostaglandinas E (PGE), em particular as prostaglandinas E2, aceleram o crescimento tumoral (Corpet e Pierre, 2003) por aumentar a proliferação de células colônicas e pela ação anti-apoptótica (Colditz et al., 1997). As PGE podem, ainda, reduzir a atividade de células natural Killer (NK) (Mazzeo, 1994), reduzir a motilidade intestinal, apresentar ação inflamatória (Colditz et al., 1997) e contribuir para metástases (Hoffman-Goetz, 1994). Por sua vez, as prostaglandinas F (PGF), em particular as prostaglandinas F2, possuem ações contrárias as PGE (Colditz et al., 1997).
O aumento de PGE pode ocorrer devido o processo inflamatório ocasionado pelo câncer. As enzimas pró-inflamatórias fosfolipase A-2 e ciclooxigenase (COX), as quais são expressas em maior quantidade nos tumores colônicos, promovem o aumento do nível de prostaglandinas E2 (Corpet e Pierre, 2003). O consumo de drogas antiinflamatórias não esteroidais (NSAIDs) (ex: ácido acetilsalicílico - aspirina), por exemplo, associam-se com a redução do risco de câncer de cólon (Colditz et al., 1997). O principal mecanismo sugerido para a proteção do câncer de cólon por estas drogas é a inibição das enzimas ciclooxigenases 1 e 2 (COX-1 e COX-2). As NSAIDs impedem que a COX-1 e COX-2 convertam o ácido araquidônico em prostaglandinas pró-inflamatórias (ex: PGE2) (Colditz et al., 1997; Montoya e Wargovich, 1997; Corpet e Pierre, 2003; Hauret et al., 2004).
A AF, por sua vez, tem se mostrado capaz de diminuir a relação (razão) de prostaglandinas E2 e F2 (PGE2 / PGF2), aparentemente por aumentar os níveis de PGF2 e, possivelmente, reduzir a concentração de PGE2 (Colditz et al., 1997). Além disso, um possível efeito antiinflamatório pela AF, semelhante ao promovido pelas NSAIDs, poderia reduzir os níveis das enzimas COXs e das prostaglandinas E (Hauret et al., 2004).
Balanço energéticoO balanço energético positivo tem sido associado ao CC por apresentar correlação positiva à adiposidade (Friedenreich e Orenstein, 2002; Westerlind, 2003) e por aumentar, geralmente, o consumo de gordura (Kritchevsky, 1990). A restrição calórica, por outro lado, protege contra o câncer (Westerlind, 2003). A restrição calórica de 10 a 40% se mostra capaz de reduzir a incidência de tumores colônicos em modelo animal com carcinogênese induzida por drogas químicas (Kritchevsky, 1990).
O exercício e AF aumentam o gasto energético e possivelmente reduzem a ingestão calórica (Westerlind, 2003). Consequentemente reduzem a adiposidade corporal. O balanço energético negativo promovido pelo exercício também promove redução de IGF-I (Yu e Rohan, 2000; Nemet et al., 2004). Quando ratos submetidos à restrição energética são suplementados com IGF-I, o efeito da restrição calórica na inibição do crescimento tumoral desaparece, e os tumores voltam a crescer na mesma taxa de animais sem restrição calórica. O balanço energético positivo, por outro lado, aumenta os níveis de IGF-I (Yu e Rohan, 2000). Acredita-se que a redução do risco de adenomas (Hauret et al., 2004) e adenocarcinomas (Kritchevsky, 1990) esporádicos no cólon pelo exercício envolve a modulação do balanço energético. Entretanto, como o exercício promove diversas alterações (ex: hormonais, imunológicas e metabólicas) no organismo, as quais poderiam confundir os resultados relativos ao balanço energético, estudos com maior controle de variáveis intervenientes serão necessários.
Função imuneA maior incidência de CC, entre outros tipos de cânceres, pode estar associada a uma imunodepressão (Friedenreich, 2001; Westerlind, 2003). Pessoas com imunodeficiência congênita apresentam, aproximadamente, 200 vezes mais chance de desenvolver algum tipo de câncer (Cotran et al., 1996). A função imune diminuída com o envelhecimento é um fenômeno ao qual se atribui o maior risco de cânceres em pessoas idosas (Mazzeo, 1994).
Células do sistema imune como os linfócitos citotóxicos T, células NK, células Killer ativadas por linfocinas (LAK), monócitos-macrófagos (Mo/MØ) e células T têm funções importantes na morte de células anormais (Westerlind, 2003). Por exemplo, células NK e LAK, as quais são ativadas por Interleucina-2 (IL-2), são componentes críticos no controle da metástase tumoral (Hoffman-Goetz, 1994; Cotran et al., 1996). As células NK se mostram como a primeira linha de defesa contra tumores (Cotran et al., 1996). Os linfócitos citotóxicos T (ex: CD8+), por sua vez, são capazes de reconhecer "peptídeos tumorais", e apresenta-los à superfície celular após ligação a moléculas da classe I do complexo principal de histocompatibilidade (MHC) (Cotran et al., 1996). Células da linhagem Mo/MØ têm poderoso efeito na inibição do crescimento do tumor, podendo destruir células cancerosas (Woods e Davis, 1994). Os macrófagos, quando ativados, podem matar células tumorais por mecanismos similares aos usados para matar bactérias, ou seja, pela produção de moléculas reativas de oxigênio ou pela secreção do fator alfa de necrose tumoral (TNF-a), que é uma citocina capaz de lisar celular tumorais. As células T contribuem para ativação dos macrófagos via secreção da citocina interferon gama (IFN-?) (Cotran et al., 1996).
Sugere-se que alterações no sistema imune provocadas pelo exercício tenham potencial tanto para inibir quanto para promover a carcinogênese (Westerlind, 2003), dependendo da duração, intensidade e freqüência do exercício (Hoffman-Goetz, 1994). O exercício exaustivo, por exemplo, tem ação imunossupressora. Após sessões de exercício intenso se observa, frequentemente, leucocitose, linfocitose, redução da proliferação de células T, redução da resposta e proliferação de linfócitos induzida por mitógeno, redução da produção de IL-2 e seus receptores, supressão de células T-helper, supressão de Mo/MØ, atrofia do baço e timo (Mazzeo, 1994; Woods e Davis, 1994). Por outro lado, o exercício de intensidade moderada e longa duração (endurance), promove liberação de citocinas derivadas de macrófagos (as quais têm propriedades antitumorais), aumento da citotoxidade antitumoral de macrófagos, a atividade e/ou número de Mo/MØ, a proliferação e resposta de linfócitos, o número e atividade de células NK, a produção de IL-2 e a atividade de LAK em humanos e animais (Hoffman-Goetz, 1994; Mazzeo, 1994; Woods e Davis, 1994; Friedenreich, 2001; Westerlind, 2003).
Estudos experimentais envolvendo exercício e carcinogênese colorretal não têm explorado a importância da modulação do sistema imune, e mais estudos são necessários.
Radicais livresA produção de radicais livres, acima da capacidade do organismo combater com o sistema de defesa antioxidante, pode resultar em danos potenciais ao ácido desoxirribonucléico (DNA), lipídios e proteínas celulares, podendo causar mutagênese da célula (Westerlind, 2003).
Discute-se que o exercício exaustivo é capaz de aumentar a produção de radicais livres, devido ao estresse oxidativo (Schneider e Oliveira, 2004). Entretanto, há evidências de que o exercício moderado de longa duração está associado a uma melhora do sistema de defesa antioxidante enzimático (ex: superóxido dismutase, glutationa peroxidase e catalase) (Powers et al., 1998; Navarro et al., 2004). Ou seja, é possível que o exercício, dependendo da sua intensidade, possa aumentar a produção de radicais livres (promovendo a carcinogênese) ou aumentar os níveis de enzimas antioxidantes (protegendo contra danos celulares) e, consequentemente, prevenindo falhas genéticas.
A Figura 1 ilustra os possíveis mecanismos de proteção contra o CC pelo exercício e AF.
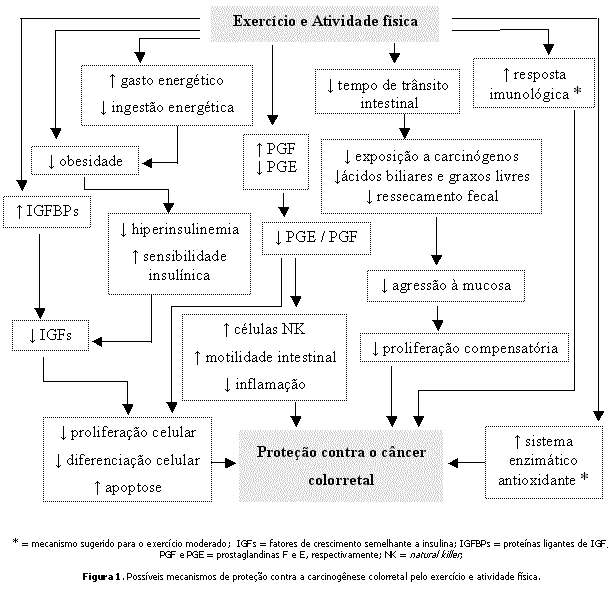
Considerações finaisEsse grande número de possíveis mecanismos de proteção do CC pelo exercício e AF sugeridos demonstra a necessidade do refinamento de hipóteses, o que apenas será alcançado com estudos experimentais bem direcionados e controlados. Uma vez que a proteção do CC pelo exercício e AF é considerada "convincente" pelas evidências já acumuladas, torna-se fundamental que os novos estudos envolvendo exercício e CC busquem explorar os mecanismos biológicos de proteção, para que, dessa forma, seja possível fazer prescrições de treinamento direcionadas especificamente para a proteção contra o CC.
Referências
ACSM. Diretrizes do ACSM para os testes de esforço e sua prescrição. Ed. Guanabara Koogan: Rio de Janeiro, 2003.
Andrianopoulos G, Nelson RI, Bombeck CL, Souza G. The influence of physical activity in 1,2 dimethylhydrazine induced colon carcinogenesis in the rat. Anticancer Res 1987; 7: 849-52.
Batty D, Thune I. Does physical activity prevent cancer? BMJ 2000; 321:1424-5.
Bird RP. Observation and quantification of aberrant crypts in the murine colon treated with a colon carcinogen: preliminary findings. Cancer Lett 1987; 37: 147-51.
Colbert LH, Davis JM, Essig DA, Ghaffar A, Mayer EP. Exercise and tumor development in a mouse predisposed to multiple intestinal adenomas. Med Sci Sports Exerc 2000; 32: 1704-8.
Colbert LH, Mam V, Perkins SN, Berrigan D, Lavigne JA, Wimbrow HH et al. Exercise and intestinal polyp development in APCmin Mice. Med Sci Sports Exerc 2003; 35: 1662-9.
Colditz GA, Cannuscio CC, Frazier L. Physical activity and reduced risk of colon cancer: implications for prevention. Cancer Causes Control. 1997; 8: 649-67.
Corpet DE, Pierre F. Point: From animal models to prevention of colon cancer. Systematic review of chemoprevention in Min Mice and choice of the model system. Cancer Epidemiol Biomarkers Prev 2003; 12: 391-400.
Cotran RS, Kumar V, Robbins SL. Patologia estrutural e funcional. 5ª edição. Ed. Guanabara Koogan: Rio de Janeiro, 1996.
Demarzo MMP, Garcia SB. Exhaustive physical exercise increases the number of colonic preneoplastic lesions in untrained rats treated with a chemical carcinogen. Cancer Lett 2004; 216: 31-4.
Freier S, Weiss O, Eran M, Flyvbjerg A, Dahan R, Nephesh I, et al. Expression of the insulin-like growth factors and their receptors in adenocarcinoma of the colon. Gut 1999; 44: 704-8.
Friedenreich CM, Orenstein MR. Physical activity and cancer prevention: etiologic evidence and biological mechanisms. J Nutr 2002; 132: 3456S-64S.
Friedenreich CM. Physical activity and cancer prevention: from observational to intervention research. Cancer Epidemiol Biomarkers Prev 2001; 10: 287-301.
Hauret KG, Bostick RM, Matthews CE, Hussey JR, Fina MF, Geisinger KR, et al. Physical activity and reduced risk of incident sporadic colorectal adenomas: observational support for mechanisms involving energy balance and inflammation modulation. Am J Epidemiol 2004; 159: 983-92.
Hoffman-Goetz L. Exercise, natural immunity, and tumor metastasis. Med Sci Sports Exerc 1994; 26: 157-63.
Hou L, Ji B, Blair A, Dai Q, Gao YT, Chow W. Commuting physical activity and risk of colon cancer in shanghai, China. Am J Epidemiol 2004; 160: 860-7.
INCA - Instituto Nacional de Câncer. Estimativa 2006: Incidência de câncer no Brasil. Disponível em: http: // www.inca.gov.br [Acessado em 01 abril 2006].
Krichevsky D. Influence of caloric restriction and exercise on tumorigenesis in rats. Proc Soc Exp Biol Med 1990; 193: 35-8.
Louro ID. Oncogenética - parte 1. Revista da Sociedade Brasileira de Cancerologia 2000; 11: 36-45.
Lunz W. Interferência do treinamento em natação com diferentes intensidades na carcinogênese experimental do cólon. Viçosa, 2006. [Dissertação de mestrado apresentada à Universidade Federal de Viçosa, como parte das exigências do curso de pós-graduação em Ciência da Nutrição]
Mazzeo RS. The influence of exercise and aging on immune function. Med Sci Sports Exerc 1994; 26: 586-92.
Mctiernan A. Physical activity, exercise, and cancer: prevention to treatment - Symposium overview. Med Sci Sports Exerc 2003, 35: 1821-2.
Mehl KA, Davis JM, Clements JM, Berger FG, Pena MM, Carson JA. Decreased intestinal polyp multiplicity is related to exercise mode and gender in Apc Min/+ mice. J Appl Physiol 2005; 98: 2219-25.
Montoya RG, Wargovich MJ. Chemoprevention of gastrointestinal cancer. Cancer Metastasis Rev 1997; 16: 405-19.
Navarro A, Gomez C, Lopez-Cepero JM, Boveris A. Beneficial effects of moderate exercise on mice aging: survival, behavior, oxidative stress, and mitochondrial electron transfer. Am J Physiol Regul Integr Comp Physiol 2004; 286: R505-R11.
Nemet D, Connoly PH, Pescatello AMP, Gottron CR, Larson JK, Galassetti P, et al. Negative energy balance plays a major role in the IGF-I response to exercise training. J Appl Physiol 2004; 96: 276-82.
Oliveira EC, Chaves-Dias CMG. Efeito do exercício físico moderado em modelo de carcinogênese de cólon em ratos Wistar. Viçosa; 2003. [Monografia apresentada à Universidade Federal de Viçosa].
Powers SK, Demirel HA, Vincent HK, Coombes JS, Naito H, Hamilton KL, et al. Exercise training improves myocardial tolerance to in vivo ischemia-reperfusion in the rat. Am J Physiol 1998; 275: 1468-77.
Reddy BS, Sugie S, Lowenfels A. Effect of voluntary exercise on azoxymethane-induced colon carcinogenesis in male F344 rats. Cancer Res 1988; 48: 7079-81.
Reinmuth N, Liu W, Fan F, Jung YD, Ahmad SA, Stoeltzing O, et al. Blockade of Insulin-like Growth Factor I Receptor function inhibits growth and angiogenesis of colon cancer. Clin Cancer Res 2002; 8: 3259-69.
Schneider CD, Oliveira AR. Radicais livres de oxigênio e exercício: mecanismos de formação e adaptação ao treinamento físico. Revista Brasileira de Medicina do Esporte 2004; 10: 308-13.
Slattery ML, Curtin K, Ma K, Edwards S, Schaffer D, Anderson K, et al. Diet, activity, and lifestyle associations with p53 mutations in colon tumors. Cancer Epidemiol Biomarkers Prev 2002; 11: 541-8.
The Cancer Council Australia. Preventable risk factors: Physical activity - National cancer prevention policy 2004-06. Journal of the HEIA, 11: 50-63, 2004.
Thorling EB, Jacobsen NO, Overvad K. Effect of exercise on intestinal tumor development in the male Fischer rat after exposure to azoxymethane. Eur J Cancer Prev 1994; 2: 31-41 (abstract).
Tomlinson I, Ilyas M, Novelli M. Molecular genetics of colon cancer. Cancer Metastasis Rev 1997; 16: 67-79.
Tsushima M, Nomura AMY, Lee J, Stemmermann GN. Prospective study of the association of serum triglyceride and glucose with colorectal cancer. Dig Dis Sci 2005, 50: 499-505 (abstract).
Westerlind KC. Physical activity and cancer prevention-mechanisms. Med Sci Sports Exerc 2003; 35: 1834-40.
Woods JA, Davis JM. Exercise, monocyte/macrophage function, and cancer. Med Sci Sports Exerc 1994; 26: 147-57.
Yu H, Rohan T. Role of the Insulin-Like Growth Factor Family in role of the Insulin-Like Growth Factor Family in cancer development and progression. J Natl Cancer Inst 2000; 92:1472-89.
 |
|
|---|---|
|
revista
digital · Año 11 · N° 102 | Buenos Aires,
Noviembre 2006 |
|